
下列中学常见实验的现象或表述正确的是( )
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为“蓝色固体”
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式______。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。该过程中发生反应的离子方程式是____________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
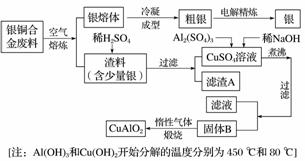
(1)电解精炼银时,阴极反应式为_______________________________;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为____________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3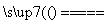 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要 1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床。海底热水矿床是沉积着由岩浆热气从地底喷出的金、铜、锌、稀有金属等区域。下列说法正确的是( )
A.金不溶于任何溶液
B.铜、锌在空气中均能被氧化成对应的氧化物
C.铜锌合金的熔点低于铜或锌的熔点
D.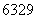 Cu的质子数和中子数之差为34
Cu的质子数和中子数之差为34
查看答案和解析>>
科目:高中化学 来源: 题型:
化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:

下列关于“苏丹红4号”说法正确的是 ( )。
A.不能发生加成反应
B.属于芳香烃衍生物
C.可以使酸性高锰酸钾溶液退色
D.属于甲苯同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
以下生活中的现象不可用原电池原理来解释的是 ( )。
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖章久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g) + H2O(g) 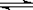 CO2(g) + H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
CO2(g) + H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
(1)平衡时CO的转化率为 ;该反应在该温度时的化学平衡常数为 。
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为 。
(3)800℃时,该反应的平衡常数为1,则该反应的△H 0(填 >,<, =)
(4)改变起始条件,在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如右下图,则0~4 min的平均反应速率v(CO)=______mol / (L·min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如左下表:
 t℃时物质浓度(mol / L)的变化
t℃时物质浓度(mol / L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 |
①表中3 min ~ 4 min之间反应处于 状态; C1数值___0.08mol / L(填大于、小于或等于)。
②反应在4 min ~ 5 min问,平衡向逆方向移动,可能的原因是________(单选),
表中5 min ~ 6 min之间数值发生变化,可能的原因是________(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com