
|
某溶液中含有大量的下列离子:Fe3+、SO42-、A13+和M离子,经测定Fe3+、SO42-、A13+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的 | |
| [ ] | |
A. |
Na+ |
B. |
OH- |
C. |
S2- |
D. |
C1- |
科目:高中化学 来源: 题型:阅读理解
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 序号 | 反应 | 平衡常数 |
| ① | Au+6HNO3(浓)?Au(NO3)3+3NO2+3H2O | <<1 |
| ② | Au3++4Cl-?AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
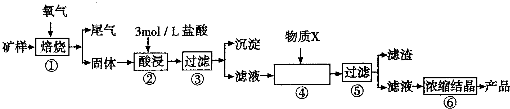
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g?L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省攀枝花市高三第三次全市检测理综化学试卷(解析版) 题型:实验题
Na2SO3、SO2是中学常见的物质。
(1)某同学用下图示装置制取干燥纯净的SO2。

写出制取SO2气体的化学方程式 。请指出D装置中的错误 。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。 |
,证明待测液中含Br-。 |
|
步骤② |
在试管B中加入少量待测液,
|
有白色沉淀生成, 证明待测液中含SO42-。 |
|
步骤③ |
在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。 |
, 证明待测液中含SO32-。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com