
| A. | 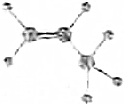 | B. | C3H6 | ||
| C. | 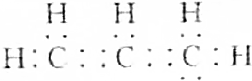 | D. | CH2═CHCH3 |
分析 丙烯分子式为C3H6,但C3H6不一定为乙烯分子,可以为环丙烷,丙烯分子中存在官能团碳碳双键,其结构式为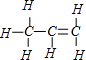 ,结构简式为:CH3CH=CH2,丙烯中存在6个碳氢共用电子对,该电子式中少一个碳氢共用电子对,电子式为
,结构简式为:CH3CH=CH2,丙烯中存在6个碳氢共用电子对,该电子式中少一个碳氢共用电子对,电子式为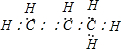 ,据此分析解答.
,据此分析解答.
解答 解:A.丙烯分子式为C3H6,图示为丙烯的球棍模型,故A正确;
B.丙烯分子式为C3H6,但C3H6不一定为乙烯分子,可以为环丙烷,故B错误;
C.丙烯中存在6个碳氢共用电子对,该电子式中少一个碳氢共用电子对,电子式为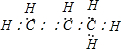 ,故C错误;
,故C错误;
D.丙烯分子中存在官能团碳碳双键,其结构式为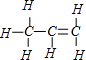 ,结构简式为:CH3CH=CH2,故D正确;
,结构简式为:CH3CH=CH2,故D正确;
故选AD.
点评 本题考查了常见化学用语的表示方法,题目难度不大,注意掌握电子式、结构简式的概念及正确表示方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入Na0H溶液并加热,鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) | |
| B. | 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 | |
| C. | 为探究温度对化学反应速率的影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 往含有FeBr2和FeI2的混合溶液中通足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
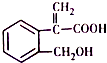
| A. | 分子式为C10H10O3 | |
| B. | 1mol 该有机物最多可与5mol氢气发生加成反应 | |
| C. | 该有机物在一定条件下,可以发生取代、氧化、消去反应 | |
| D. | 1mol 该有机物与足量钠反应生成22.4L氢气(标况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
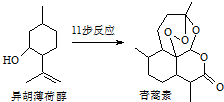 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇的分子式为C10H12O | |
| B. | 青蒿素提取时可以通过加热或加碱溶解的方法提高其浸取率 | |
| C. | 青蒿素易溶于水,而难溶于有机溶剂 | |
| D. | 异胡薄荷醇可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com