
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用分液法分离酒精和水 |
| C、用四氯化碳萃取碘水中的碘 |
| D、用蒸馏的方法将自来水制成蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:漂白粉溶液Y:二氧化硫 |
| B、X:硝酸银溶液Y:氨气 |
| C、X:氢氧化钡溶液Y:二氧化碳 |
| D、X:偏铝酸钠溶液Y:二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
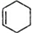 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.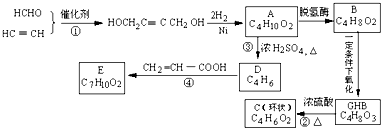
 结构),它的结构简式为
结构),它的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯 | B、丙烯 | C、丁烯 | D、戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲中沉淀一定比乙中的多 |
| B、甲中沉淀可能比乙中的少 |
| C、甲中沉淀一定比乙中的少 |
| D、甲中和乙中的沉淀可能一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.6mol/L |
| B、3.2mol/L |
| C、2.8mol/L |
| D、2.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.
如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com