
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
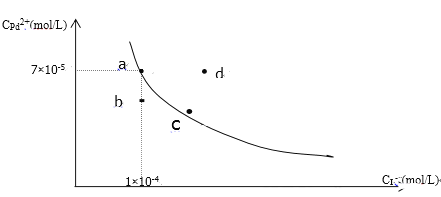
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
【答案】C
【解析】
A. 在t℃时PdI2的Ksp=7.0×10-5×(1×10-4)2=7×10-13,故A错误;
B. 图中a点是饱和溶液,b变为a铅离子的浓度增大,即b点不是饱和溶液,d变为a点要减小碘离子的浓度,说明d点是饱和溶液,故B错误;
C. 向a点的溶液中加入少量NaI固体,即向溶液中引入碘离子,碘离子浓度增大,PdI2的溶解平衡向生成沉淀的方向移动,铅离子浓度减小,溶液由a点向c点方向移动,故C正确;
D. 沉淀溶解的过程为断键过程,要吸热,即正反应沉淀溶解过程吸热,要使d点移动到b点,即使饱和溶液变为不饱和溶液,降低温度,溶解平衡向放热的方向移动,即生成沉淀的方向移动,仍为饱和溶液,故D错误。
答案选C。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,则下列说法不正确的是
A. 标准状况下,18gH2O所含电子数为10NA
B. 22.4L CO2与17 g NH3所含分子数相等
C. 0.9g铝与足量的盐酸反应,失去的电子数为0.1NA
D. 常温下,1L 0.1mol/L NaCl溶液中含Na+ 数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
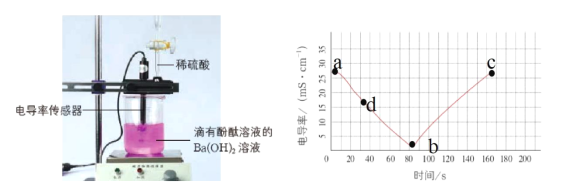
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
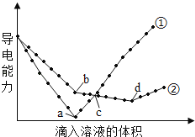
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业上从海水中提取Mg的流程,下列说法正确的是
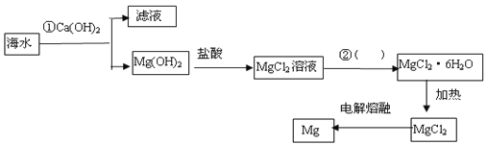
A.①反应的离子方程式是Mg2++2OH-=Mg(OH)2↓
B.②的实验操作不可以是蒸发浓缩、冷却结晶、过滤
C.工业上不会用电解熔融氧化镁制镁
D.MgCl26H2O可以直接加热得无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
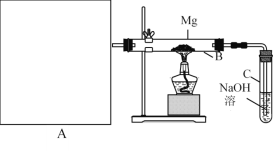
Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室利用铜与浓硫酸制取二氧化硫并探究它的性质,请回答下列问题:
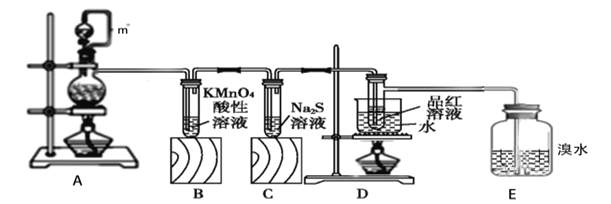
(1)装置A中m的作用___,装置A中有明显的一处错误___。
(2)装置A中发生的化学反应方程式___,该反应的氧化产物是__________。
(3)装置B中的现象________,证明SO2具有________。
(4)装置C中溶液在空气中不易保存,时间长了会出现浑浊,原因是_______。(用离子方程式表示)
(5)装置D的目的是探究SO2与品红作用的可逆性,写出实验操作及现象__。
(6)E中的现象是___,发生的化学反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题:
(1)基态N的原子核外___种运动状态不同的电子,基态 P原子核外电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为___。
(2)PCl3分子中的中心原子杂化轨道类型是__,该分子构型为____。
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式__。
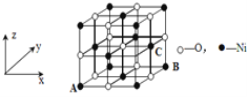
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO___NiO(填“>”、“<”或“=”),理由是__。
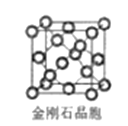
(5)金刚石晶胞含有__个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___a,列式表示碳原子在晶胞中的空间占有率___(请用r和a表示不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
Ⅰ.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O![]() ,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
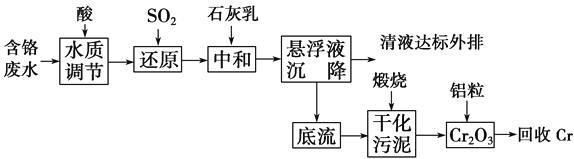
(1)请写出通入SO2时发生的离子反应:______________________________________。
(2)写出加入铝粒时发生反应的化学方程式____________________________________。
Ⅱ.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成分。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其他成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(3)铬渣烧结炼铁法中煤粉的作用是____________。(写两点)
(4)请配平碱性溶液还原法中发生的离子反应:_______________
![]() Cr2O72-+
Cr2O72-+![]() S2-+
S2-+![]() H2O===
H2O===![]() Cr(OH)3↓+
Cr(OH)3↓+![]() S2O32-+
S2O32-+![]() OH-
OH-
(5)用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物可能是________(填序号);
①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4
在这些混合物中,各成分的物质的量之比是________。
Ⅲ.电解法处理
工业上处理含Cr2O72-离子的酸性废水,采用以下处理方法。①往工业废水中加入适量的食盐(1~2 g·L-1),搅拌均匀;②用Fe为电极进行电解;③鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准。其原理是:①将Cr2O![]() 离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
(6)加入食盐的目的是______________________________________________________;电解时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.将1L0.1mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为0.1NA
B.常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子
C.1L0.1mol/L Na2SO4溶液中含有0.4NA个氧原子
D.在标准状况下,22.4L的CCl4所含的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com