
分析 (1)反应的方程式为K37C1O3+6H35C1=KC1+3C12↑+3H2O,生成的Cl2中35Cl与37Cl个数比为5:1,然后根据摩尔质量与相对分子质量在数值上相等计算;
(2)根据86号元素位于第六周期第0族进行分析判断;
(3)氨气催化氧化生成一氧化氮,一氧化氮继续氧化生成红棕色二氧化氮,二氧化氮与水反应生成硝酸,分析aNO2+bO2+cH2O=dHNO3中元素化合价变化计算a:b值.
解答 解:(1)反应的方程式为K37C1O3+6H35C1=KC1+3C12↑+3H2O,生成的Cl2中35Cl与37Cl个数比为5:1,则生成的氯气相对分子质量约为$\frac{35×5+37}{3}$=70.7
,故答案为:70.7;
(2)因为86号元素位于第六周期第0族,所以金元素的原子序数为79,它在元素周期表中位于第六周期IB族,故答案为:六;IB;
(3)氨气催化氧化生成一氧化氮,一氧化氮继续氧化生成红棕色二氧化氮,二氧化氮与水反应生成硝酸,现象为:无色气体变为红棕色;aNO2+bO2+cH2O=dHNO3,反应中氮从+4价升高为+5价,氧从0价降为-2价,依据得失电子守恒,二氧化氮系数为4,氧气系数为1,所以:a:b=4:1;
故答案为:无色气体变为红棕色;4:1.
点评 本题考查了同位素的分析计算,元素位置的确定以及氨气的性质,明确氨气的化学性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烷烃分子中,可能会有碳碳双键 | |
| B. | 烷烃中除甲烷外,很多都能使紫色KMnO4溶液褪色 | |
| C. | 分子通式为CnH2n+2的烃不一定是烷烃 | |
| D. | 所有的烷烃在光照条件下都能与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl 2溶液中,共含有Cl - 个数为 N A | |
| B. | 1mol任何气体的体积都为 22.4L | |
| C. | 7.8gNa 2O 2中所含阴离子的数目是0.1N A | |
| D. | 标准状况下,2.24L水中含有的分子数为0.1N A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l?)H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液.溶液变红:NH3•H2O═NH4++OH- | |
| D. | 向澄清石灰水中通入过量CO2,溶液变浑浊:Ca2++CO2+2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| D. | 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
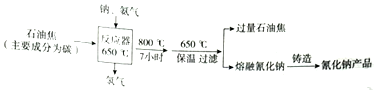

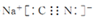 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
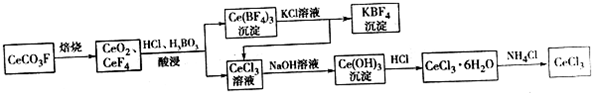
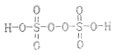 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com