
| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向正反应方向移动了 | D. | a>b |
分析 采用假设法分析,假设a=b,保持温度不变,将容器体积增加一倍,平衡不移动,A和B的浓度应均是原来的0.5倍,与达到新的平衡时B的浓度相比判断平衡移动,再根据平衡移动逐项判断.
解答 解:采用假设法分析,假设a=b,保持温度不变,将容器体积增加一倍,平衡不移动,A和B的浓度应均是原来的0.5倍,但当达到新的平衡时,B的浓度是原来的40%,说明减小压强平衡向逆反应反应方向移动.
A、因为平衡常数仅与温度有关,所以将容器体积增加一倍,则平衡常数不变,故A错误;
B、平衡时B的浓度是原来的40%,小于原来的0.5倍,说明平衡向逆反应反应方向移动,A的转化率减小,故B错误;
C、增大体积,压强减小,平衡向逆反应方向移动,故C错误;
D、增大体积,压强减小,平衡向逆反应方向移动,则说明a>b,故D正确;
故选:D.
点评 本题考查化学平衡移动问题,题目难度不大,注意通过改变体积浓度的变化判断平衡移动的方向,此为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+H2O?NH3•H2O | D. | HCl+NH3═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 碳酸氢钠溶液与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 铁与氯化铁溶液反应:Fe3+Fe═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 标准状况下,22.4 L水所含的水分子数为NA | |
| C. | 在常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 34g氨气所含质子数目为20 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
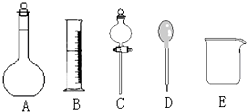 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成240mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成240mL 0.1mol•L-1的盐酸溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米材料TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2•xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2.
纳米材料TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2•xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸,其合成路线如图所示.
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸,其合成路线如图所示.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com