
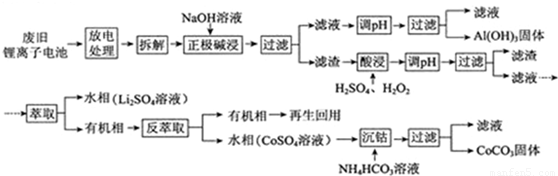
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导热剂乙炔黑和铝箔等,充电时,该锂离子电池负极发生的反应为6C+xLi+xe—==LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
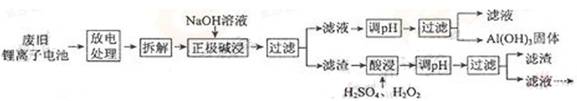

回答下列问题:
(1)LiCoO2中,Co元素的化合价为
(2)写出“正极碱浸”中发生反应的离子方程式
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式
;可用盐酸代替H2SO4和H2O2的混合液,但缺点是
(4)写出“沉钴”过程中发生反应的化学方程式
(5)充放电过程中,发生LiCoO2与Li1—xCoO2之间的转化,写出放电时电池反应方程式
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是
。在整个回收工艺中,可回收到的金属化合物有
(填化学式)
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷带解析) 题型:填空题
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。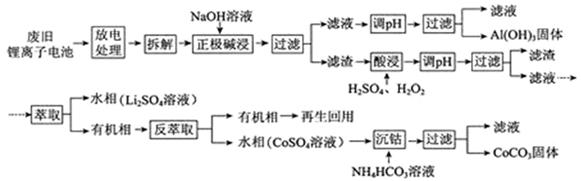
回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷解析版) 题型:填空题
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
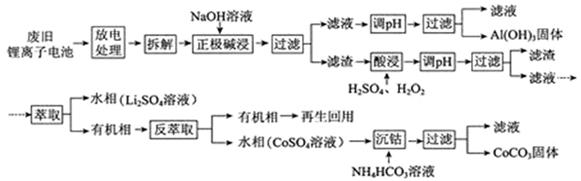
回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
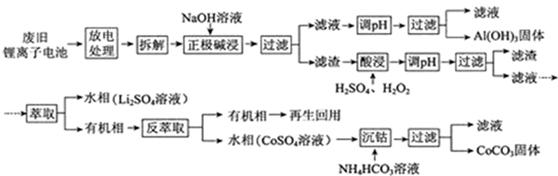
查看答案和解析>>
科目:高中化学 来源:2013年全国统一高考化学试卷(新课标Ⅰ卷)(解析版) 题型:解答题
 2H2O+O2↑
2H2O+O2↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com