
在一定温度下,反应A2(g)+B2(g) ![]() 2AB(g)达到平衡状态的标志是______
2AB(g)达到平衡状态的标志是______
A.单位时间内生成n mol A2的同时生成n mol AB
B.容器内的总压强不随时间变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成n mol A2的同时生成n mol B2
E.容器内A2、B2、AB的物质的量之比是1∶1∶2时的状态
F.容器中[A2]=[B2]=[AB]时的状态
解析:化学平衡状态的根本标志是v(正)=v(逆),或平衡混合物中各组分的浓度或质量分数、体积分数等保持不变。只要具备上述两点之一,便一定是平衡状态;否则,不能确定为平衡状态。A项,根据化学方程式中的化学计量数之比,可知生成n mol AB必消耗![]() mol A2,即单位时间内生成
mol A2,即单位时间内生成![]() mol A2的同时生成n mol AB,显然反应未达到平衡状态。B项,是从压强方面来叙述的。由于此反应是反应前后气体分子数不变的反应,达到平衡或未达到平衡时压强都不随时间变化,因此不能用压强来说明反应是否达到平衡状态。C项,由题意可知当单位时间内生成2n mol AB时,也就消耗了n mol A2和n mol B2,这样同一时刻相同容积的容器中消耗的A2和生成的A2都是n mol,说明反应处于平衡状态。D项,只知道单位时间生成n mol A2和n mol B2,却不知道同时消耗多少A2和多少B2,故无法确定反应是否达到平衡。E、F两项是以混合物成分的含量来叙述的。由于达到化学平衡状态时,反应混合物中各物质的浓度保持不变,并不是相等,也不是它们的分子数之比一定等于其化学方程式中各物质的化学计量数之比,所以E、F两项不符合题意。
mol A2的同时生成n mol AB,显然反应未达到平衡状态。B项,是从压强方面来叙述的。由于此反应是反应前后气体分子数不变的反应,达到平衡或未达到平衡时压强都不随时间变化,因此不能用压强来说明反应是否达到平衡状态。C项,由题意可知当单位时间内生成2n mol AB时,也就消耗了n mol A2和n mol B2,这样同一时刻相同容积的容器中消耗的A2和生成的A2都是n mol,说明反应处于平衡状态。D项,只知道单位时间生成n mol A2和n mol B2,却不知道同时消耗多少A2和多少B2,故无法确定反应是否达到平衡。E、F两项是以混合物成分的含量来叙述的。由于达到化学平衡状态时,反应混合物中各物质的浓度保持不变,并不是相等,也不是它们的分子数之比一定等于其化学方程式中各物质的化学计量数之比,所以E、F两项不符合题意。
答案:C


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
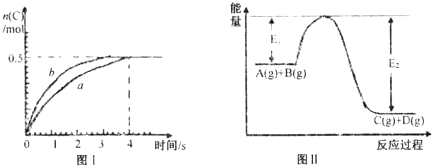
| A、此反应过程中的能量变化可用上图II表示 | B、此温度下,该反应的平衡常数的值为1 | C、该反应4s内平均速率v(A)=0.125mol?L-1?s-1 | D、若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:021
在一定温度下,反应
A(气)+B(气)[ ]
A.正反应速率增大时,平衡将向右移动B.升高温度平衡向左移动,则正反应肯定是放热反应
C.使用催化剂时,正、逆反应速率同等加快,平衡不会发生移动
D.增大压强,将会使平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com