
中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理: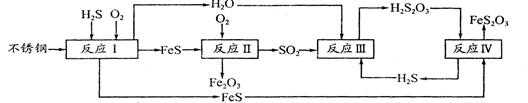
(1)H2S来自合成尿素的天然气。在380 K、体积为2 L的密闭容器中,存在如下反应:H2(g)+S(s) H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。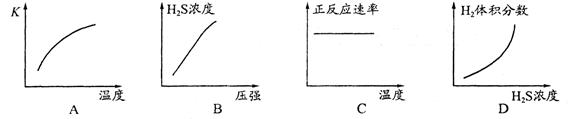
(2)在反应I中发生的化学反应为______。
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负
极为______;
已知:Fe(s)+S(s)=FeS(s) △H1=-2.5akJ·mol-1
S(s)+O2(g)=SO2(g) △H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-6akJ·mol-1
则反应II的热化学方程式为_____
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,该溶液中电荷守恒式为_____ ;反应IY的反应类型为______ ;该反应______(填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为______;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为
__________________
(1)除去铁钉表面的铁锈;(2)⑤①④②③(3)4Fe+3O2+6H2O=4Fe(OH)3;吸入导管内的品红溶液;(4)铁钉的表面积(温度、催化剂)(5)①溶液的酸性太强,铁容易发生析氢腐蚀;
②6.0<PH≤6.5 ③配置不同浓度的NaCl溶液;
解析试题分析:(1)反应前后气体的体积不变,用平衡时H2、H2S的物质的量代替浓度计算,故该反应的平衡常数k=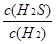 =
=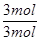 =1;A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大,图象与实际相符合,正确;B.增大压强平衡不移动,但容器体积减小,硫化氢的浓度增大,正确;C.升高温度反应速率加快,图象中正反应速率不变,错误;D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变,图象与实际不相符,错误;(2)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水,反应方程式为:2Fe+2H2S+O2=2FeS+2H2O;(3)由流程图可知,反应II中FeS与氧气反应生成氧化铁与二氧化硫,FeS发生氧化反应,为负极;已知:①Fe(s)+S(s)═FeS(s)△H1═-2.5akJ/mol;
=1;A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大,图象与实际相符合,正确;B.增大压强平衡不移动,但容器体积减小,硫化氢的浓度增大,正确;C.升高温度反应速率加快,图象中正反应速率不变,错误;D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变,图象与实际不相符,错误;(2)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水,反应方程式为:2Fe+2H2S+O2=2FeS+2H2O;(3)由流程图可知,反应II中FeS与氧气反应生成氧化铁与二氧化硫,FeS发生氧化反应,为负极;已知:①Fe(s)+S(s)═FeS(s)△H1═-2.5akJ/mol;
②S(s)+O2(g)═SO2(g)△H2═-5akJ/mol9;
③4Fe(s)+3O2(g)═2Fe2O3(s)△H3═-6akJ/mol
根据盖斯定律,③-①×4+②×4得:4FeS(s)+7O2(g)═2Fe2O3(s)+4SO2(g)△H=-16akJ/mol
(4)由电离平衡常数可知,H2S2O3属于弱酸,Na2S2O3为强碱弱酸盐,溶液呈碱性;
阳离子带的电离等于阴离子带的电离,故c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);
反应Ⅳ是H2S2O3与FeS反应生成FeS2O3与H2S,方程式为:H2S2O3+FeS=FeS2O3+H2S↑,符合复分解反应,反应能进行由于生成硫化氢气体,不能说明FeS溶解性更强,(5)由流程图可知,最终腐蚀产物为Fe2O3、FeS2O3;硫化氢与硫酸铜反应生成硫化铜沉淀与硫酸,反应离子方程式为:Cu2++H2S=CuS↓+2H+。
考点:化学平衡常数的含义;金属的电化学腐蚀与防护;难溶电解质的溶解平衡及沉淀转化的本质.


科目:高中化学 来源: 题型:填空题
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。试根据图中数据,填写下列空白: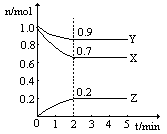
(1)从开始至2min,Z的平均反应速率为 。
(2)该反应的化学方程式为 。
(3)保持温度和体积不变,若n(X)=2mol,n(Y)="3" mol,n (Z)=1mol,该反应向 (填“正反应”或“逆反应”) 方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。 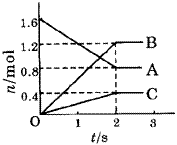
A、B、C三种物质的物质的量随时间变化的关系图
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较 。
| A.无法确定 | B.⑷一定大于⑴ | C.⑷一定等于⑴ | D.⑷一定小于⑴ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题: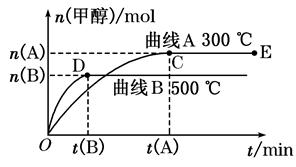
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时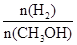 增大 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: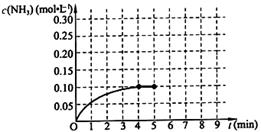
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)= 。
⑵下列描述中能说明上述反应已达平衡的是 。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。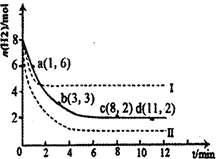
①下列时间段平均反应速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 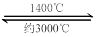 WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。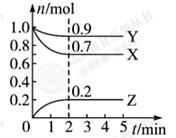
根据图中数据回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为 。
(3)用物质X表示的化学反应速率为0.2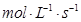 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1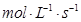 ,哪个快?( )
,哪个快?( )
a.前者 b.后者 c.一样快 d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 (填“增大”“减小”或“相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com