
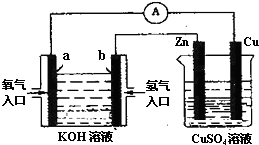
 如图装置中盛KOH溶液的部分是一个氢氧燃料电池,对此装置的分析合理的是( )
如图装置中盛KOH溶液的部分是一个氢氧燃料电池,对此装置的分析合理的是( )

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为 黄绿 黄绿 色 |
继续通入的氯气溶于水使溶液呈黄绿色 继续通入的氯气溶于水使溶液呈黄绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com