
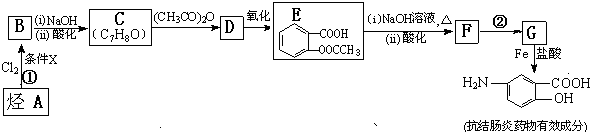
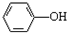
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$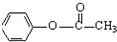
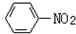 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$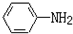
 .
. .
. .
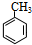
.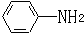 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物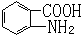 的合成路线
的合成路线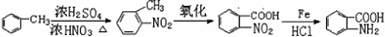 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题) 分析 C发生信息(a)中的反应生成D,D发生氧化反应生成E,结合C的分子式与E的结构简式,可知C的结构简式为 ,则D为
,则D为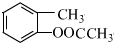 ,D用酸性高锰酸钾溶液氧化得到E.烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为
,D用酸性高锰酸钾溶液氧化得到E.烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为 ,B为
,B为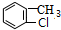 .E与氢氧化钠反应、酸化得到F为
.E与氢氧化钠反应、酸化得到F为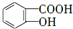 ,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为
,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为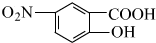 ,G发生还原反应得到抗结肠炎药物有效成分;
,G发生还原反应得到抗结肠炎药物有效成分;
(6)甲苯和浓硝酸发生取代反应生成邻甲基硝基苯,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸.
解答 解:C发生信息(a)中的反应生成D,D发生氧化反应生成E,结合C的分子式与E的结构简式,可知C的结构简式为 ,则D为
,则D为 ,D用酸性高锰酸钾溶液氧化得到E.烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为
,D用酸性高锰酸钾溶液氧化得到E.烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为 ,B为
,B为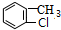 .E与氢氧化钠反应、酸化得到F为
.E与氢氧化钠反应、酸化得到F为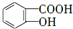 ,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为
,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为 ,G发生还原反应得到抗结肠炎药物有效成分,
,G发生还原反应得到抗结肠炎药物有效成分,
(1)由上述分析可知,烃A的结构简式是 ,故答案为:
,故答案为: ;
;
(2)①的反应条件是FeCl3作催化剂,②的反应类型是取代反应,
故答案为:FeCl3作催化剂;取代反应;
(3)A.羧基、氨基与水分子之间可以形成氢键,其水溶性比苯酚好,密度比苯酚的大,故A正确;
B.不能发生消去反应,故B错误;
C.含有羧基、氨基,可以发生聚合反应,故C正确;
D.含有羧基、氨基,既有酸性又有碱性,故D正确,
故答案为:ACD;
(4)E与足量NaOH溶液反应的化学方程式是: ,
,
故答案为: ;
;
(5) ,
,
故答案为: ;
;
(6)甲苯和浓硝酸发生取代反应生成邻甲基硝基苯,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸,其合成路线为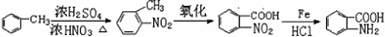 ,
,
故答案为: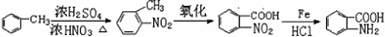 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合应用能力,明确官能团及其性质关系是解本题关键,难点是合成路线设计,要根据反应物及合成物质结构特点选取合适的制取方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤(不要求写出具体操作过程) | 与其的实验现象和结论 |
| 将所得沉淀过滤、洗涤… | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,假如足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 淀粉通过下列转化可以得到多种有机物
淀粉通过下列转化可以得到多种有机物查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NH4HSO4固体,v(H2)不变 | B. | 加入少量水,v(H2)减小 | ||
| C. | 加入CH3COONa固体,v(H2)减小 | D. | 滴加少量CuSO4溶液,v(H2)加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中.观察气泡快慢; | 验证温度对化学反应速率的影响. |
| B | 碘化钾溶液滴到土豆片上 | 证明淀粉遇碘变蓝 |
| C | 盐酸加入碳酸钠溶液中产生CO2 | 证明氯的非金属性比碳强 |
| D | 取规格相同的绿豆大的钠分别加入到水和乙醇中 | 证明乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com