
| A. | HF、HCl、H2S、PH3的稳定性依次增强 | |
| B. | Na、Mg、Al、Si的还原性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
分析 A.非金属性越强,氢化物越稳定;
B.同周期,从左向右金属性减弱;
C.电子层越多,原子半径越大,同周期原子序数大的原子半径小;
D.金属性越强,最高价氧化物的水化物碱性越强.
解答 解:A.非金属性F>Cl>S>P,HF、HCl、H2S、PH3的稳定性依次减弱,故A错误;
B.同周期,从左向右金属性减弱,则Na、Mg、Al、Si的还原性逐渐减弱,故B错误;
C.电子层越多,原子半径越大,同周期原子序数大的原子半径小,则O、S、Na、K的原子半径依次增大,故C正确;
D.金属性K>Ca>Mg>Al,KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐减弱,故D错误;
故选C.
点评 本题考查非金属性的性质,为高频考点,把握元素的位置、性质及元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
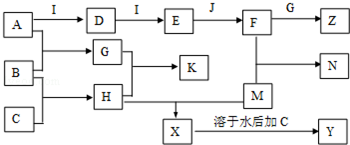
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
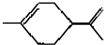 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H18 | |
| D. | 与过量的溴的CCl4溶液反应后产物为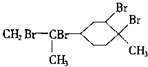 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑦ | ⑥ | ||
| 四 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物,可用于杀菌消毒和供氧剂 | |
| B. | 高纯度单质硅有良好的半导体性能,可用于制备光电池 | |
| C. | 氨气是一种碱性气体,可用碱石灰或CaCl2干燥 | |
| D. | SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 共价化合物也能含有离子键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H-H键断裂的同时有1 mol H-I键形成 | |
| B. | 1 mol H-H键断裂的同时有2 mol H-I键形成 | |
| C. | 1 mol I-I键断裂的同时有2 mol H--I键形成 | |
| D. | 1 mol H-H键断裂的同时有1 mol I-I键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
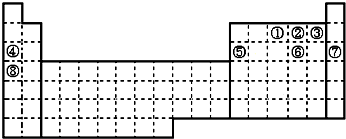
 (用化学式表示,下同);写出②含有10个中子的核素的化学符号818O.
(用化学式表示,下同);写出②含有10个中子的核素的化学符号818O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com