
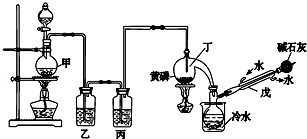
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
分析 实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:甲装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,丙装置利用浓硫酸干燥氯气,利用Cl2排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用冰水欲装置防止PCl3挥发(冷凝),蒸馏烧瓶中得到的粗产品含有POCl3、PCl5等.加入黄磷加热除去PCl5后,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应.
(1)由图可知仪器的名称;
(2)实验室制备氯气用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(3)根据制备的氯气中的杂质分析;
(4)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气;
(5)碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;
(6)在加热条件下,黄磷与PCl5反应生成PCl3;PCl3沸点较低,加热易挥发.
解答 解:甲装置中为浓盐酸与二氧化锰反应生成氯气,氯气中含有的杂质为HCl、水蒸气,分别用饱和食盐水和浓硫酸除去,纯净的氯气与黄磷在加热条件下反应生成气态的PCl3,冷却达到液态的PCl3;
(1)仪器戊名称从装置中分析为冷凝管,
故答案为:冷凝管;
(2)实验室制备氯气用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)氯气中含有的杂质为HCl、水蒸气,分别用饱和食盐水和浓硫酸除去,所以乙中盛放的试剂是饱和氯化钠溶液用于除去氯气中的氯化氢,丙中盛放的试剂是浓硫酸用于除去水蒸气;
故答案为:饱和氯化钠溶液,除去氯气中的氯化氢;浓硫酸,除去氯气中的水蒸气;
(4)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应;通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应,
故答案为:排净装置中的空气,防止空气中的水分和氧气与PCl3反应;
(5)氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度,
故答案为:碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(6)在加热条件下,黄磷与PCl5反应生成PCl3,则反应的方程式为:3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3;PCl3沸点较低,加热易挥发,可以利用蒸馏的方法分离出三氯化磷;
故答案为:3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3;蒸馏.
点评 本题考查物质的制备和分离提纯实验方案设计,注意对实验原理理解,题目难度中等,是对知识的综合运用的考查,需要学生具有扎实的基础与综合运用分析解决问题的能力


科目:高中化学 来源: 题型:实验题
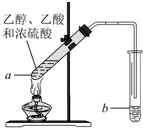 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
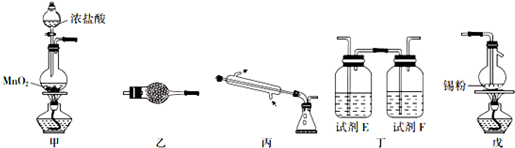
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ | |
| C. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ | |
| D. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
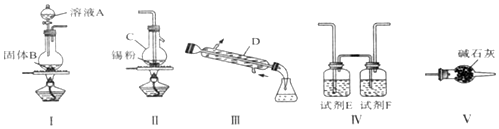
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
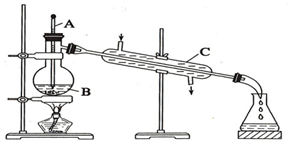 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:5:4 | B. | 5:4:2 | C. | 2:4:5 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 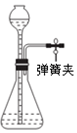 打开弹簧夹,由漏斗中加水至产生液面差,液面高度差不变时,说明装置气密性良好 | |
| B. | 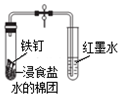 打开弹簧夹一段时间后,红墨水倒吸入导气管中,说明铁钉发生了析氢腐蚀 | |
| C. | 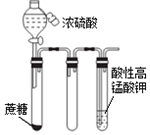 滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明产生了还原性气体 | |
| D. | 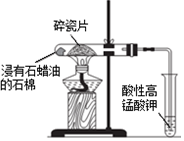 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com