
【题目】M,R,X,Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
(1)R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .
(3)X与M形成的XM3分子的空间构型是 .
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号). 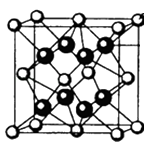
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .
【答案】
(1)1s22s22p63s1;Cl
(2)H2O分子能形成氢键,而H2S不能形成氢键
(3)平面三角形
(4)Na+
(5)3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4
【解析】解:M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,核外电子排布式为1s22s22p4 , 故M为O元素;由原子序数可知R、X、Y均处于第三周期,R是同周期元素中最活泼的金属元素,则R为Na;X和M形成的一种化合物是引起酸雨的主要大气污染物,则X为S元素,可知Y为Cl;Z的基态原子4s和3d轨道半充满,外围电子排布式为3d54s1 , 处于VIB族,故Z为Cr.
(1.)R为Na,基态原子的电子排布式是1s22s22p63s1 , 同周期自左而右电负性增大,故Cl元素电负性大于S的,所以答案是:1s22s22p63s1;Cl;
(2.)H2O分子能形成氢键,使水的沸点升高,而H2S不能形成氢键,故硫化氢的沸点低于水的,所以答案是:H2O分子能形成氢键,而H2S不能形成氢键;
(3.)X与M形成的SO3分子中S原子孤电子对数= ![]() =0,价层电子对数为3+0=3,故其空间构型为平面三角形,所以答案是:平面三角形;
=0,价层电子对数为3+0=3,故其空间构型为平面三角形,所以答案是:平面三角形;
(4.)M和R所形成的一种离子化合物为Na2O,晶胞中黑色球数目为8,白色球数目为8× ![]() +6×
+6× ![]() =4,黑色球与白色球数目之比为2:1,故图中黑球代表的离子是Na+ , 所以答案是:Na+;
=4,黑色球与白色球数目之比为2:1,故图中黑球代表的离子是Na+ , 所以答案是:Na+;
(5.)Z的最高价含氧酸的钾盐(橙色)为K2Cr2O7 , 与氧元素的氢化物发生氧化还原反应,该氢化物为H2O2 , 在稀硫酸中,Cr元素被还原为+3价,H2O2被氧化生成氧气,反应方程式为:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4 , 所以答案是:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4 .


科目:高中化学 来源: 题型:
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_____________________________________________,所得溶液中c(H+)- c(OH-)=___________________________(填写表达式)
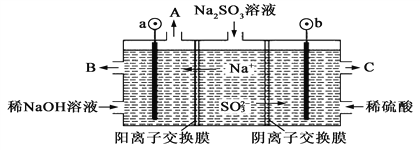
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如右图所示(电极材料为石墨)。
① 图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②SO32-放电的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:

(1)四种元素的所有化合价中,最低负化合价为______价,最高正化合价为_____价。
(2)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为_________;化合物乙是一种离子化合物,常用作化肥,其化学式为________。
(3)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:____________________。
(4)元素Y和W能形成一种化合物YW3。YW3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空。
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.Fe还原水体中NO3﹣的反应原理如图所示. 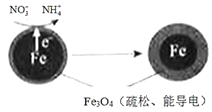
①作负极的物质是 .
②正极的电极反应式是 .
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如表:
化学键 | H﹣H | C﹣O | C﹣O | H﹣O | C﹣H |
E/(KJmol﹣1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=kJmol﹣1 . 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com