
【题目】![]() 在药物和染料的制取中有重要作用,沸点69℃,100℃以上分解生成两种常见气体。实验室对其稳定性和分解产物的部分性质分别进行了如下探究。已知:反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体。
在药物和染料的制取中有重要作用,沸点69℃,100℃以上分解生成两种常见气体。实验室对其稳定性和分解产物的部分性质分别进行了如下探究。已知:反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体。
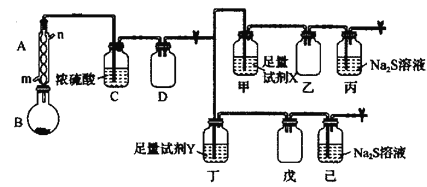
回答下列问题:
(1)装置A中的进水口为______,仪器B的名称为______,加热B的方式最好选用______(填“水浴加热”或“油浴加热”)。
(2)装置C的作用为____________,装置D的作用为____________。
(3)试剂X、Y分别为下列试剂中的______、______(填标号)。
a.品红溶液 b.氢氧化钠溶液 c.高锰酸钾溶液 d.四氯化碳
(4)若进入丙中的气体过量,则丙中的现象为____________,发生反应的离子方程式为__________________。
【答案】m 圆底烧瓶 油浴加热 通过观察气泡速率调节油浴温度,控制反应速率 安全瓶,防止倒吸 d c 溶液变浑浊 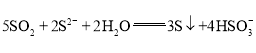
【解析】
现实验室欲对![]() 的稳定性和分解产物的部分性质分别进行探究,已知反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体,则
的稳定性和分解产物的部分性质分别进行探究,已知反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体,则![]() 分解生成氯气和二氧化硫,已知
分解生成氯气和二氧化硫,已知![]() 在100℃以上分解,则可采用油浴加热装置B,通过观察装置C中的气泡速率调节油浴温度,控制反应速率;装置D作安全瓶,可防止倒吸;装置甲用于除去二氧化硫中的氯气,在装置丙中二氧化硫与硫化钠溶液反应生成硫单质,溶液变浑浊;装置丁用于除去氯气中的二氧化硫,在装置己中氯气氧化硫化钠生成硫单质,溶液变浑浊;装置乙和装置戊均作安全瓶,可防止倒吸,据此分析解答。
在100℃以上分解,则可采用油浴加热装置B,通过观察装置C中的气泡速率调节油浴温度,控制反应速率;装置D作安全瓶,可防止倒吸;装置甲用于除去二氧化硫中的氯气,在装置丙中二氧化硫与硫化钠溶液反应生成硫单质,溶液变浑浊;装置丁用于除去氯气中的二氧化硫,在装置己中氯气氧化硫化钠生成硫单质,溶液变浑浊;装置乙和装置戊均作安全瓶,可防止倒吸,据此分析解答。
(1)冷凝管的冷凝水应下口进上口出,则应从m口进水;仪器B的名称为圆底烧瓶;已知![]() 在100℃以上分解,则加热B的方式最好选用油浴加热,故答案为:m;圆底烧瓶;油浴加热;
在100℃以上分解,则加热B的方式最好选用油浴加热,故答案为:m;圆底烧瓶;油浴加热;
(2)可通过观察装置C浓硫酸中的气泡速率调节油浴温度,控制反应速率;装置D作安全瓶,可防止倒吸;
(3)装置甲中试剂X用于除去二氧化硫中的氯气,因此试剂X应能吸收氯气,而不能吸收二氧化硫,因此应选择四氯化碳;装置丁中试剂Y用于除去氯气中的二氧化硫,因此试剂Y能吸收二氧化硫,而不能吸收氯气,因此应选择高锰酸钾溶液,故答案为:d;c;
(4)过量二氧化硫与硫化钠反应生成硫单质和亚硫酸氢钠,则丙中溶液变浑浊,发生反应的离子方程式为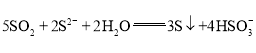 。
。


科目:高中化学 来源: 题型:
【题目】将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 2 | 1 | 0.4 | 1 | |
下列说法不正确的是
A. 该反应的正反应为放热反应
B. 实验1中,前5min用CO表示的速率为0.16 mol/(L·min)
C. 实验2中,平衡常数K=1/6
D. 实验3跟实验2相比,改变的条件可能是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L15NH3中含有的质子数为11NA
B.含63gHNO3的浓硝酸与足量铜完全反应,转移电子数大于0.5NA
C.常温下,1L![]() 溶液中含有的氮原子数小于0.2NA
溶液中含有的氮原子数小于0.2NA
D.标准状况下,224mLSO2溶于水后形成的溶液中![]() 、
、![]() 、
、![]() 粒子数之和等于0.01NA
粒子数之和等于0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于Fe与水蒸气反应后的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
实验之前查阅资料得知Fe3+的盐溶液遇到KSCN溶液时,溶液变成红色,而Fe2+遇KSCN溶液无明显变化。
[猜想]甲组:黑色物质是FeO
乙组:黑色物质是Fe3O4
丙组:____________;
[实验探究]
(1)丙组认为一种简单定性的方法即可判断甲组的正误:取生成的黑色物质少许于烧杯中,加稀盐酸使其完全溶解,再加________溶液以检验Fe3+,观察到溶液有无出现________现象即可判断。
(2)乙组认为可通过定量测定来确定生成的黑色物质的组成,以验证该组猜想正确。取生成的黑色物质2.32 g溶解于适量稀盐酸后,加入新制氯水,加入氯水后反应的离子方程式为__________,再加入足量NaOH溶液后,过滤、洗涤、烘干、灼烧、称量,若称得固体质量为________,即可判断乙组同学猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是
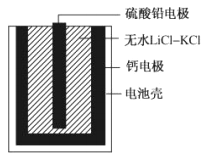
A. 放电过程中,Li+向负极移动
B. 正极反应式:Ca+2Cl-—2e-=CaCl2
C. 每转移0.1mol电子,理论上生成10.35gPb
D. 常温时,在正负极间接上电流表或检流计,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
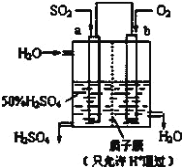
①上述生产硫酸的总反应方程式为_____,b 是_____极,b 电极反应式为______________,生产过程中H+向_____(填 a 或 b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置一定需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
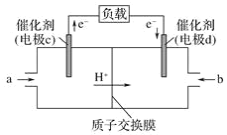
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)质子交换膜左右两侧的溶液均为1L 2mol·L-1H2SO4溶液。燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为___________________________。当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
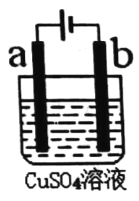
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com