
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q在常温下不易反应 | |
| C. | 最高价氧化物的水化物的酸性:L>Z | |
| D. | M单质容易形成离子化合物 |
分析 短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X有+2价,处于ⅡA族,原子半径X>S,则X为Mg元素;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素,M有+4、-4价,而且半径S>M>O,则M为C元素,结合元素周期律及物质的结构与性质解答.
解答 解:短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X有+2价,处于ⅡA族,原子半径X>S,则X为Mg元素;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素,M有+4、-4价,而且半径S>M>O,则M为C元素,
A.X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;
B.Q为O元素,Y为Al元素,常温下,Y与Q形成化合物为Al2O3,故B错误;
C.非金属性Cl>S,非金属性越强,其最高价氧化物水化物的酸性越强,所以最高价氧化物的水化物的酸性:L>Z,故C正确;
D.M为C元素,最外层有四个电子,不容易得失电子,易形成共价键,故D错误,
故选C.
点评 本题考查元素的性质与位置关系,利用原子半径及化合价来推断出元素是解答关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应限度可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到反应限度(化学平衡)时,正、逆反应速率相等 | |
| D. | 可以通过改变外界条件控制化学反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
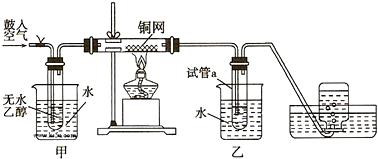
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率相等且都为零 | B. | 化学反应停止 | ||
| C. | 反应物和生成物共存 | D. | 反应物和生成物浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 部分结构知识 | 部分性质 | |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3 (n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com