
| A. | 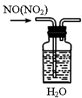 除去NO中的NO2 | B. | 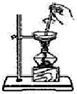 用于AlCl3蒸发结晶 | ||
| C. | 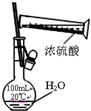 稀释浓硫酸 | D. |  制备少量O2 |
分析 A.NO2与水反应生成NO;
B.蒸发时氯化铝水解生成的HCl挥发;
C.不能在容量瓶中稀释浓硫酸;
D.过氧化钠为粉末固体,不能利用止水夹使固体与液体分离制备少量气体.
解答 解:A.NO2与水反应生成NO,则导管长进短出、洗气可除杂,故A正确;
B.蒸发时氯化铝水解生成的HCl挥发,直接蒸发不能得到氯化铝,应在HCl气流中蒸发得到氯化铝,故B错误;
C.不能在容量瓶中稀释浓硫酸,应在烧杯中稀释、冷却后转移到容量瓶中,故C错误;
D.过氧化钠为粉末固体,不能利用止水夹使固体与液体分离制备少量气体,装置不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、盐类水解、溶液配制及气体制备实验等,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、OH-、SO42- | B. | Ag+、NH4+、OH-、NO3- | ||
| C. | Mg2+、Na+、AlO2-、OH- | D. | MnO4-、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰、白磷、熟石灰 | B. | 干冰、铁、氯化氢 | ||
| C. | 天然气、氮气、胆矾 | D. | 烧碱、液态氧、碘酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | KHSO4?K++H++SO42- | ||
| C. | Ba(OH)2?Ba2++2OH- | D. | NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下:
已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com