
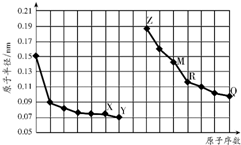
| A. | R在周期表的第14列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为氧元素,Y为F元素,Z为Na元素,M为Al元素,R为Si,Q为Cl元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为氧元素,Y为F元素,Z为Na元素,M为Al元素,R为Si,Q为Cl元素.
A.R为Si元素,位于周期表第14列,故A正确;
B.F元素不存在最高价含氧酸,故B错误;
C.O2-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,故C正确;
D.Na与氯化铝溶液反应,首先与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铝反应,不能置换出Al,故D错误,
故选AC.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,审题中要抓住“短周期主族元素”几个字.


科目:高中化学 来源: 题型:选择题
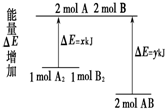
| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
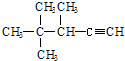 的系统名称为( )
的系统名称为( )| A. | 2,2,3-三甲基-1-戊炔 | B. | 3,4,4-三甲基-4-戊炔 | ||
| C. | 3,4,4-三甲基-1-戊炔 | D. | 2,2,3-三甲基-4-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
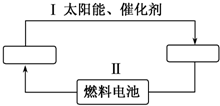 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )| A. | 应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,采用烟气脱硝技术 | |
| B. | 不放烟花焰火,加强道路扬尘污染控制,强化路面保洁,洒水防尘 | |
| C. | 在炼油厂.钢铁厂.发电厂等,推广和使用脱硫技术,降低硫氧化物的排放 | |
| D. | 研究采煤.采油新技术,增加汽油.柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
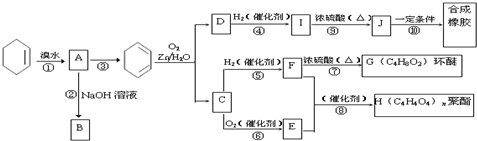
 ; COHC-CHO
; COHC-CHO +2nH2O,
+2nH2O,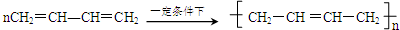
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com