
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 60gSiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键
B. H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
C. 1L0.2mo1/ LNaHCO3溶液中含HCO3-和CO32-的离子数之和为0.2NA
D. 足量的Mg与稀H2SO4完全反应,生成2.24LH2时,转移的电子数为0.2NA
【答案】B
【解析】
A.60g二氧化硅和12g金刚石的物质的量均为1mol,而1mol金刚石中含2molC-C键,1mol二氧化硅中含4molSi-O键,故1mol二氧化硅中含4NA条Si-O键,故A错误;B.H2O(g)通过Na2O2(s)增重的是氢元素的质量,且增重2g时转移1mole-,故当增重bg时,转移的电子的物质的量为![]() ×1即
×1即![]() mol,个数为
mol,个数为![]() 个,故B正确;C.1L0.2mo1/ LNaHCO3溶液中,HCO3-既水解又电离,根据物料守恒,含H2CO3、HCO3-和CO32-的总数之和为0.2NA,则HCO3-和CO32-的总数之和小于0.2NA,故C错误;D.生成的2.24LH2,没有指明温度和压强,不知道具体的摩尔体积,无法计算其物质的量,故D错误;故答案为B。
个,故B正确;C.1L0.2mo1/ LNaHCO3溶液中,HCO3-既水解又电离,根据物料守恒,含H2CO3、HCO3-和CO32-的总数之和为0.2NA,则HCO3-和CO32-的总数之和小于0.2NA,故C错误;D.生成的2.24LH2,没有指明温度和压强,不知道具体的摩尔体积,无法计算其物质的量,故D错误;故答案为B。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.75×105,下列说法正确的是
A. 相同体积 pH 均为 3 的 HCOOH 和 CH3COOH 溶液,中和 NaOH 的能力相同
B. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后:c(HCOO-)+c(OH-)>c(Na+)+c(H+)
C. 均为 0.1 mol·L-1 的 HCOOH 和 NH3·H2O 溶液中水的电离程度相同
D. 0.1 mol·L-1 CH3COOH 溶液中逐滴加入 0.1 mol·L-1 HCl溶液中 不变。
不变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题:
(1)学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容如图Ⅰ,现欲用此硫酸配制配制成浓度为0.50molL﹣1的稀硫酸100mL.①所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外还需________。
②所取浓硫酸的体积为________ mL。
(2)写出上述装置中仪器的名称:②________;③________。
(3)若利用装置Ⅱ分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,将仪器补充完整后进行的实验操作的名称为________。
(4)实验室常用装置Ⅲ分离碘水中的碘, 进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有乙醇的烧杯中投入一小块金属钠,可以观察到的现象是( )
A.钠块沉在乙醇液面下面B.钠块熔成小球
C.钠块在乙醇液面上游动D.钠块表面无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.把CaCl2放入水中:CaCl2===Cu2++Cl2-
B.把NaHSO4放入水中:NaHSO4===Na++H++SO![]()
C.把Ba(OH)2放入水中:Ba(OH)2=== Ba 2++(OH)2-
D.把H2SO4放入水中:H2SO4=== H2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验描述正确的是
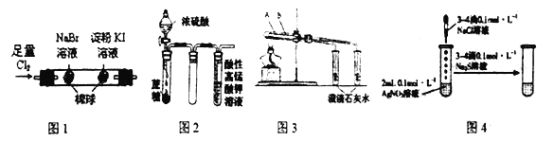
A. 图1:左边棉花变为橙色,右边棉花变为蓝色,还原性:C1-<Br-<I-
B. 图2:酸性KMnO4溶液中出现气泡,但颜色无变化
C. 图3:可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体
D. 图4:试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>ksp(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化生成X和Y(少量),X和Y中Mo价态相同,硝酸本身被还原为NO2,该反应中氧化剂与还原剂的物质的量之比为6:1,则Mo在氧化产物中的化合价为___________;
(2)已知:2Mo(s)+3O2(g)===2MoO3(s) △H1;
MoS2(s)+2O2(g)===Mo(s)+2SO2(g) △H2。
写出MoS2(s)与氧气反应生成MoO3(s)的热化学方程式_____________________________;
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
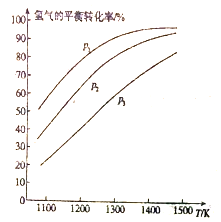
(a)不同压强下温度与H2平衡转化率的关系

(b)0.1MPa下温度与平衡时气体成分的关系
①由图(a)可知,该反应△H___________0(填“>”或“<”),p1、p2、p3由大到小的顺序为___________;
②由图(b)可知,B点时H2的平衡转化率为___________;
③A点对应的平衡常数K=___________(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
①辉钼矿应放入电解槽的___________(填“阴极区”或“阳极区”);
②阴极的电极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A. 粉身碎骨浑不怕,要留清白在人间
B. 野火烧不尽,春风吹又生
C. 春蚕到死丝方尽,蜡炬成灰泪始干
D. 爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com