
实验中需用2.0 mol/L的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )
A.950 mL;201.4 g B.500 mL;100.7 g
C.1000 mL;201.4 g D.1 000 mL;212.0 g
科目:高中化学 来源: 题型:
下列括号中的物质是除去杂质所需的药品,其中错误的是
A.NaCl中有杂质Na2SO4(氯化钡) B.FeSO4中有杂质CuSO4(铁粉)
C.CO2中有少量HCl气体(氢氧化钠溶液) D.CO2中有少量CO(灼热的氧化铜)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子因发生氧化还原反应而不能大量共存的是( )
A. H+、Na+、CO32—、Cl— B. Ca2+、K+、S2﹣、ClO—
C. Fe2+、CO32—、Cl—、NO3— D. HCO3—、Br—、OH—、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是____ __。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
_____________________________________________________________________
(2)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________
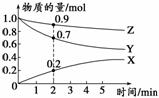 (3)某温度时,在2 L容器中X、Y、Z三种气体的物质的
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的
量随时间变化的曲线如图所示。由此分析,该反应的化
学方程式为___________________________________;
从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为若加水稀释至1000L,则溶液的pH为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com