
【题目】有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元碱BOH与等浓度的HCl溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
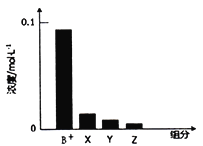
A. BOH为强碱 B. 该混合液pH=7
C. 图中X表示BOH,Y表示H+,Z表示OH- D. 该混合溶液中:c(Cl-)=c(Y)+c(B+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的连接并填空:
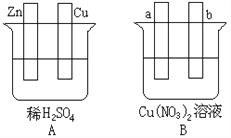
(1)在A图中,使铜片上冒气泡。请加以必要联接,则联接后的装置叫_______________。电极反应式:锌电极:________________________________;铜电极:_____________________________。
(2)在B图中(a,b都为惰性电极),使a极析出铜,则b析出:_______________。加以必要的联接后,该装置叫________________。电极反应式: b极:________________________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值____________(升高、降低、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为________。
(2)该气体所含原子总数为________。
(3)该气体在标准状况下的体积为________。
(4)该气体在标准状况下的密度为________。
(5)该气体一个分子的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验;下列预期实验现象及相应结论均正确的是( )

a | b | 预期实验现象 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用 98%的浓硫酸(ρ=1.84g/cm3 )配制 1mol/L 稀硫酸 480mL.
(1)实验中应选用的玻璃仪器除了量筒、烧杯、玻璃棒外还需要_____ (填仪器名称)
(2)实验操作:
a.用量筒量取 98%的浓硫酸;
b.将稀释后的浓硫酸转移到容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒 2~3 次,并将洗涤液转移到容量瓶中; d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌; e.向容量瓶中直接加蒸馏水至刻度线 1~2cm 处; f.盖上容量瓶瓶塞,摇匀,装瓶,贴标签;g.用胶头滴管小心加蒸馏水至刻度线;
(3)实验
①步骤 a 中应该取浓硫酸______ mL;
②正确的操作步骤是 _____(填序号).
③下列操作使所配溶液的浓度偏高的有_____ (填字母符号)
A. 使用容量瓶配制溶液时,俯视刻度线定容
B. 取用敞口放置过长时间的浓硫酸
C. 容量瓶用蒸馏水洗净后还剩有少量水
D. 量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶
E. 量取浓硫酸时俯视刻度线
II.某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃, 101KPa)下的气体摩尔体积.拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为 A、_____.
(2)实验开始时,测量实验中生成 H2 的体积除了上下移动量筒使液面与广口瓶相平,平视读取量筒内 水的体积外,还要注意_____ 。
(3)实验中准确测得 3 个数据:实验前铝硅合金的质量 m1g,实验后残留固体的质量 m2g,实验后量筒中 液面读数为 V mL,则通常状况下气体摩尔体积 Vm= _____L/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com