
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1阶段的c(B)变化未画出).乙图为t时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是

A. 若t1=15s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004molL-1s-1
B. t4~t5阶段改变的条件一定为减小压强
C. 该容器的容积为2L,B的起始物质的量为0.02mol
D. 该化学反应方程式为3A(g)B(g)+2C(g)
【答案】C
【解析】A.若t1=15s,生成物C在t0~t1时间段的平均反应速率v=![]() =
=![]() mol/(Ls)=0.004mol/(Ls),A正确; C.因为改变条件,正、逆速率下降且相等,而反应前后气体分子数不变,在t4~t5阶段改变的条件一定为减小压强,B正确; C.根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
mol/(Ls)=0.004mol/(Ls),A正确; C.因为改变条件,正、逆速率下降且相等,而反应前后气体分子数不变,在t4~t5阶段改变的条件一定为减小压强,B正确; C.根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为![]() =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,C错误;D.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,C错误;D.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)![]() B(g)+2C(g),D正确。答案选C。
B(g)+2C(g),D正确。答案选C。


科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g) ![]() COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大
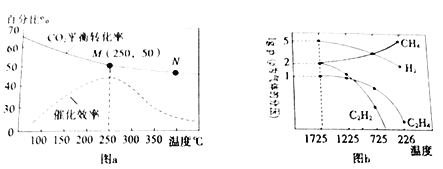
Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g)![]() C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g)![]() C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,点3的反应速率V正>V逆
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀(温度升高,NiS、NiCO3Ksp均增大),298K时,溶液中阳离子、阴离子浓度的负对数关系如图所示。下列说法不正确的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热(忽略蒸发),b点向c点移动
D. M为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法错误的是( )
A.实验室少量的钠保存在煤油中
B.氢氟酸(HF)保存在无色的玻璃瓶中
C.氢氧化钠溶液保存在带橡皮塞的玻璃瓶中
D.新制的氯水保存在棕色玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用焦炭、二氧化硅的混合物在高温下与氧气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是某化学小组制备干景的氧气并在实验室制备SiCl4的部分装置示意图(注: SiCl4遇水易水解)。


(1)选择上图部分装置,制备纯净干燥的氯气,正确的仪器连接顺序为:发生装置甲→___→____→_____→_____→装置A(用小写字母填空)。_____________
(2)上图C装置的作用是_______________。
(3)装置A的硬质玻璃管中二氧化硅和焦炭与氯气恰好完全反应生成SCl4,则二氧化硅和碳的物质的量之比为_________________。
(4)经过讨论,该小组认为D中吸收尾气一段时间后,除了过量的OH-,吸收液中阴离子肯定存在Cl-和SO42-,原因是__________(用离子方程式解释)。
(5)有同学认为可能还存在其它酸根离子(忽略空气中CO2的影响),提出下列假设(不考虑各因素的叠加),假设1:只有SO32-,假设2:只有ClO-,假设3:……
设计实验验证上述假设1和假设2:取少量吸收液于试管中,滴加3mol/LH2SO4至溶液呈酸性,然后将所得溶液分置于a、b两试管中,请填写空白的实验步骤、预期现象。
实验步骤(简述操作过程) | 预期現象 | 结论 |
向a试管中滴加几滴品红溶液,观察现象,加热试管a,观察到 | ____________。 ____________。 | 假设1成立 |
向b试管中滴加______________ | 溶液变为蓝色。 | 假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O![]() VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是
VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是

A. 全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 全钒液流电池充电时,V3+被氧化为VO2+
D. 电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应均为吸热反应,其中一定不能自发进行的是
A. CO(g)=C(s)+ ![]() O2(g) B. 2N2O5(g)=4NO2(g)+O2(g)
O2(g) B. 2N2O5(g)=4NO2(g)+O2(g)
C. (NH4)2CO3(s)=NH4HCO3(s)+NH3(g) D. MgCO3(s)==MgO(s)+CO2(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com