
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
科目:高中化学 来源: 题型:
| A、氧气、氧化镁、四氯化碳、水 |
| B、硫酸铜、氯化钠、碳酸钙、硫化钾 |
| C、硫酸、碳酸钠、氯化镁、氧化钠 |
| D、硝酸银、氢氧化钠、醋酸钠、氯化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
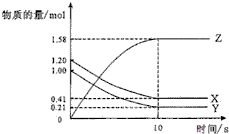 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑦① | B、②③⑦① |
| C、②⑤⑦① | D、④②⑥① |
查看答案和解析>>
科目:高中化学 来源: 题型:
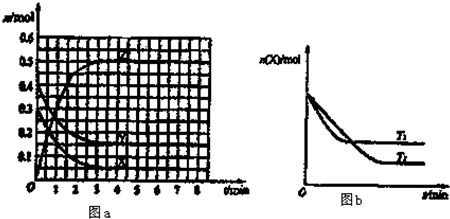
| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
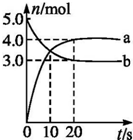 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
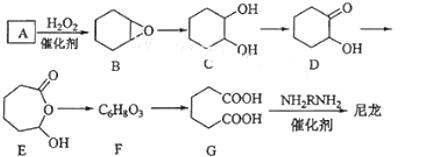
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| nB |
| tB |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com