
| A. | 一纸多用,尽量提高纸张的使用效率 | |
| B. | 回收处理,不乱扔、乱丢废纸屑 | |
| C. | 在高浓度氧气中燃烧,不产生废弃物 | |
| D. | 积累、保存送造纸厂处理 |
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色不再变化 | |
| B. | 单位时间内生成nmol氢气的同时生成nmol碘蒸气 | |
| C. | 若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化 | |
| D. | 2v正(H2)=v逆(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
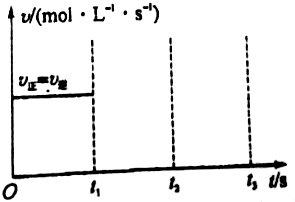 工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.
工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | KSP | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-52 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-38 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
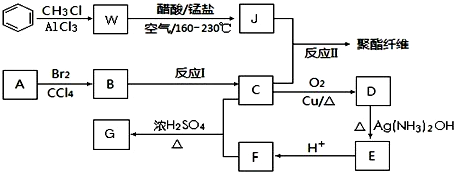
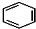 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$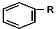 +HCl(-R为烃基)
+HCl(-R为烃基)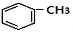 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$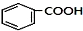
 .
.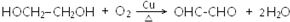 .
.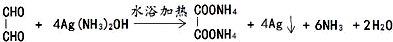 .
.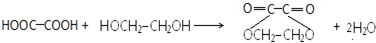 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
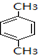
| A. | 苯与浓硫酸共热并保持70-80℃反应生成苯磺酸 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
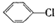 制备
制备 步骤:
步骤: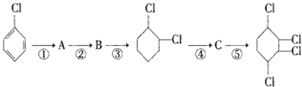
 ,B
,B ,C
,C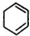
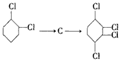 的化学方程式①
的化学方程式①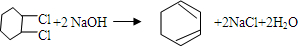 ②
②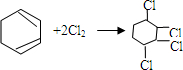 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com