


科目:高中化学 来源: 题型:
| A、取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C、取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | AgNO3 | Ba(OH)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 35.8 | |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| A、2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2 |
| B、2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓ |
| C、2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2 |
| D、2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
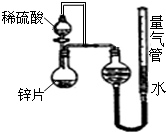 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
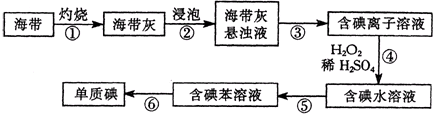
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n |
| B、一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积 |
| C、某气态烃CxHy与足量O2恰好完全反应(温度>100℃),如果反应前后气体体积不变,则y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2具有漂白性 |
| B、均与水反应生成NaOH,因而均是碱性氧化物 |
| C、Na2O中氧-2价,Na2O2中氧-1价 |
| D、均可与H2O、CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、第②步属于物理变化 |
| C、从第④~⑤步的目的是浓缩、富集溴单质 |
| D、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
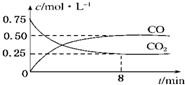 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| c(CO) |
| c(CO2) |
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com