

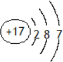 ,A为Na2O2,电子式为
,A为Na2O2,电子式为 ,I为Fe(OH)3,
,I为Fe(OH)3,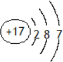 ;
; ;Fe(OH)3;
;Fe(OH)3;

科目:高中化学 来源: 题型:
| A、过氧化钠固体与水反应:2O2-+2H2O=4OH-+O2↑ | ||
B、在H2O2中加入酸性KMnO4溶液:2M
| ||
| C、醋酸溶液与大理石反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||
| D、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、Fe2+、NO3-(稀硫酸) |
| B、Al3+、K+、HCO3-、NO3-(NaOH溶液) |
| C、NH4+、Ag+、K+、NO3-(NaOH溶液) |
| D、Na+、K+、AlO2-、SiO32-(稀硝酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
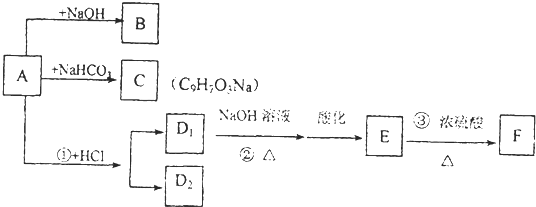
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(HCO3)2溶液与澄清石灰水混合:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、FeCl3溶液中通入足量H2S气体:2Fe3++3S2-=2FeS↓+S↓ |
| C、AlCl3溶液中加入过量的氨水溶液:Al3++4OH-=AlO2-+2H2O |
| D、等物质的量的Ba(OH)2和 NH4HCO3在大量的水中混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
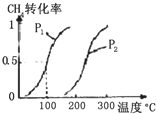 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com