
【题目】为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是_______,解释产生该气体的原因是(用化学方程式表示)____________________________。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学根据A中气体的颜色推测试纸变蓝时发生的反应可能是(写离子方程式)____________________________;乙同学认为使试纸变蓝的原因也可能是____________________________。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为:_________________________________________________。
【答案】O2 2Na2O2+4HCl=4NaCl+2H2O+O2↑ Cl2+2I-=I2+2Cl- O2也具有氧化性,也可能将I-氧化为I2 Na2O2+4HCl=2NaCl+Cl2↑+2H2O
【解析】
(1)HClO有漂白性,氯气和水反应生成HClO;O2、Cl2都具有强氧化性,都能将碘离子氧化为I2,I2遇淀粉试液变蓝色;
(2)装置B中湿润的淀粉碘化钾试纸变蓝,则产生的是碘单质,具有氧化性的物质将I-氧化的结果,在反应的过程中,过氧化钠和盐酸之间反应可能得到氧气还可能会产生氯气;
(3)根据元素守恒知,生成物中还有水生成,该反应中O元素化合价由-1价变为-2价、Cl元素化合价由-1价变为0价,根据转移电子相等配平方程式。
(1)无色气体能使带火星的木条复燃,据此推断该气体是O2,O2具有助燃性,氧气可能是过氧化钠和盐酸反应得到的,化学方程式是:2Na2O2+4HCl=4NaCl+2H2O+O2↑;
(2)装置A中剧烈反应,有黄绿色气体产生,该气体能够使装置B中湿润的淀粉碘化钾试纸变蓝,根据气体的颜色推测该气体可能是Cl2,反应方程式是:Cl2+2I-=I2+2Cl-;Na2O2和盐酸反应的过程中会产生O2,O2也具有氧化性,也可能将I-氧化为I2;
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,根据元素化合价升降总数相等,结合原子守恒,可得该反应的化学方程式为Na2O2+4HCl=2NaCl+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】如图是一个能对负载供电的电池装置。下列说法正确的是

A. b极是负极
B. a极电极反应式为H2-2e-═2H+
C. 负载通过1mol电子,右池产生标况下5.6L气体
D. 电池总反应式为:H++OH-═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
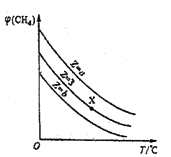
A. 该反应的焓变△H>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中n(H2O)/n(CH4)=3
D. 温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A. 1∶2∶3 B. 1∶6∶9 C. 1∶3∶3 D. 1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学为了制备氯气并探究其性质,回答下列问题。
Ⅰ.写出实验室制取氯气的离子方程式:_______________________________
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:

(1)浓硫酸的作用是___________________。
(2)证明氯气和水反应的实验现象为__________。
(3)ICl的性质与Cl2类似,写出ICl与水反应的化学方程式是______________________。
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是______________________。漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是重要的基本化工原料,常用于基本化学合成、冶金等,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_________________________________;
(2)现代开采金矿:先以NaCN溶液浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液;再用锌与Na[Au(CN)2]溶液发生置换反应生成金。“粉碎”的目的是______________;“浸取”反应的氧化剂是______________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com