
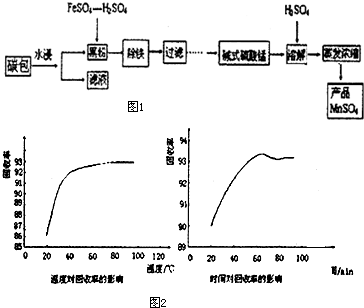
| 4 |
| X |
| 1 |
| 10-3CV |
| 0.348CVg |
| 0.500g |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |
| Br2 |
| CCl4 |
| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH不变,有氢气放出 |
| B、溶液的pH增大,有氧气放出 |
| C、溶液中Na+数目减小,有氧气放出 |
| D、溶液中c(Na+)增大,有氧气放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
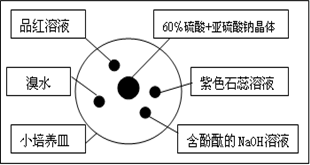
| A、溴水橙色褪去,原因是SO2气体具有漂白性 |
| B、含酚酞的NaOH溶液红色变浅,原因是SO2气体具有漂白性 |
| C、品红溶液褪色,原因是SO2气体具有漂白性 |
| D、紫色石蕊溶液变蓝色,原因是SO2气体具有酸性和漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 雾.试完成下列问题:
雾.试完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com