
| A. | 五氯化磷 | B. | 二氧化硫 | C. | 二氟化氙 | D. | 光气(COCl2) |
分析 分子中的原子满足8电子稳定结构的判断方法是:如果该元素的化合价的绝对值+该原子的最外层电子数=8,该原子满足8电子稳定结构,否则不是,由此分析解答.
解答 解:A、PCl5中Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构,故A错误;
B、S原子最外层电子数为6,所以4+6=10,分子中S原子不满足8电子结构,故B错误;
C、二氟化氙,Xe最外层是10个电子,不符合题意,故C错误;
D、光气(COCl2)C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,符合题意,故D正确;
故选D.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8O的有机物不一定是醇 | |
| B. | 乙烯与溴发生加成反应生成1,2-二溴乙烷 | |
| C. | 蛋白质、葡萄糖、脂肪在一定条件下都能发生水解反应 | |
| D. | 用乙醇和浓H2SO4 制备乙烯时,温度计的水银球应浸没于液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
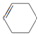 ).其中既能使酸性KMnO4溶液褪色,又能与溴水反应使溴水褪色的是( )
).其中既能使酸性KMnO4溶液褪色,又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②③⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
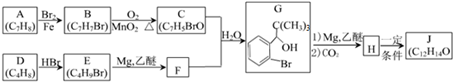
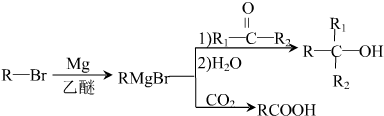
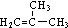 ,D分子中最多有8个原子共平面.
,D分子中最多有8个原子共平面.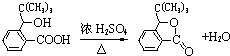 (写明反应条件).
(写明反应条件).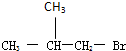 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C8H10 | C3H5Cl | C4H8O2 | C4H9ClO |
| 限定条件 | 芳香烃 | 能发生加成反应 | 能与氢氧化钠溶液反应 | 能与钠反应 |
| A. | ③②①④ | B. | ②③①④ | C. | ③①②④ | D. | ②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-n | B. | a+m | C. | a-m | D. | a+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com