
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
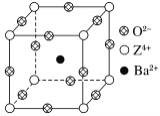
(1) Y在周期表中位于______________;Z4+的核外电子排布式为___________________。
(2)X的该种氢化物分子构型为________,X在该氢化物中以_______方式杂化。X和Y形成的化合物的熔点应该_______(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是_____________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】实验室常用热的氢氧化钠溶液洗去试管内壁沾有的硫单质,发生反应6NaOH+3S![]() 2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
A. 硫既是氧化剂又是还原剂 B. 硫化钠是还原产物
C. 硫既表现氧化性又表现还原性 D. 消耗3 mol 硫,转移电子6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如下表所示:
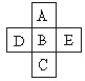
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是____,在周期表第___周期,第______族,其原子结构示意图______。
(Ⅱ)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A_____,D_____,E_____。
(2)A、C两种元素最高价氧化物的水化物之间反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________ ;
(2)表中能形成两性氢氧化物的元素是 ________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式:_________;
(3)③⑦⑩三种元素的阴离子还原性顺序为: _________________;⑦单质的水溶液呈__________色;
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 _______(填物质化学式) ;(提示:同周期元素,从左到右非金属性逐渐增强。)
(5)③元素与⑩元素两者核电荷数之差是 ____________ ;
(6)设计实验方案:比较⑦与⑥单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
____________________ | ____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“物质的量的单位——摩尔”计量的对象是( )
A. 商场货品(如文具等)B. 细小物品(如米粒等)
C. 微观粒子(如分子等)D. 只有分子、原子和离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用量筒量取液体,初次视线与量筒内凹液面的最低处保持水平,读数为9.8mL。倒出部分液体后,俯视凹液面的最低处,读数为3.5mL,则该学生实际倒出液体的体积
A. 大于6.3mLB. 小于6.3mLC. 等于6.3mLD. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。
(1)元素周期表的非金属元素中,属于主族元素的共有________种。
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。
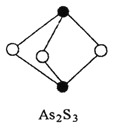
其分子中S原子的杂化方式为________。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______。
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH>CH3COOH。据此推测,pKa:ClCH2COOH______FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式: ________(若存在配位键,请用箭头标出)。
(5)磷化硼的晶胞模型如右图所示,晶胞参数为apm,已知B、P的原子半径分别表示为rBpm、rPpm。该晶胞中磷原子的配位数为________,晶体中原子的空间利用率为______。
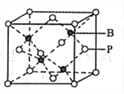
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com