
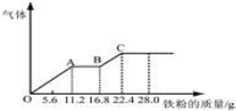
 某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )| A. | 每份溶液中NO-3物质的量为 0.4mol | |
| B. | 原溶液中H2SO4浓度为2.5mol•L-1 | |
| C. | 第一份溶液中最终溶质为CuSO4和 Cu(NO3)2 | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═Fe2+,BC段产生氢气 |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑.
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.最终消耗22.4g,溶液中溶质为FeSO4,根据Fe原子、硫酸根守恒计算硫酸物质的量,进而计算硫酸的浓度;
C.由A、B可知每一份中硝酸、硫酸物质的量,计算每一份中氢离子、硝酸根物质的量,根据3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O过量计算判断;
D.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应.
解答 解:由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑.
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每一份中n(NO3-)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,故A错误;
B.最终消耗22.4g,反应消耗22.4g铁,物质的量$\frac{22.4g}{56g/mol}$=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是$\frac{0.4mol}{0.1L}$=4mol/L,故B错误;
C.每一份中氢离子物质的量为0.2mol+0.4mol×2=1mol,硝酸根物质的量为0.2mol,19.2gCu的物质的量为$\frac{19.2g}{64g/mol}$=0.3mol,根据3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,0.3molCu完全反应消耗0.2molNO3-、0.8molH+,NO3-完全反应,而H+有剩余,则溶液中最终溶质为CuSO4和H2SO4,故C错误;
D.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故D正确.
故选:D.
点评 本题以图象为载体,考查有关金属和酸反应的计算题,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,


科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X元素形成的气态氢化物分子的空间结构是三角形 | |
| B. | Z与W元素形成的化合物是分子晶体 | |
| C. | W单质受热蒸发时吸收的热量用于克服共价键 | |
| D. | 化合物XW3中W的化合价为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 饱和氯水中:NH4+、SO32-、SO42-、Cl- | |
| C. | c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗和容量瓶时,首先要查漏 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 向试管中加液体时,胶头滴管不能紧贴试管内壁 | |
| D. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24LCl2与足量水应,消耗1.8g H2O | |
| C. | 已知有N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ•mol-1,如果该反应吸收的能量为46.0kJ,则形成N-H键的数目为3NA | |
| D. | 32g铜和足量硫完全反应,生成Cu2S,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
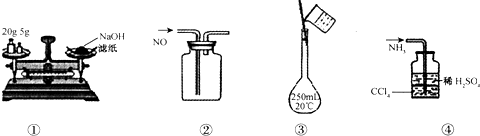
| A. | ①称量氢氧化钠固体 | B. | ②收集NO气体 | ||
| C. | ③配制100 mL 0.10 mol•L-1盐酸 | D. | ④吸收NH3不会造成倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| B. | 氯化铵和碘都可以用加热的方法进行提纯 | |
| C. | 氯水、SO2均能使品红溶液褪色 | |
| D. | 溴蒸汽和NO2气体都能使湿润的淀粉碘化钾试纸变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com