
某学习小组拟设计如下图所示实验装置验证Ba(OH)2溶液和H2SO4溶液发生的是离子反应(夹持仪器略去)。
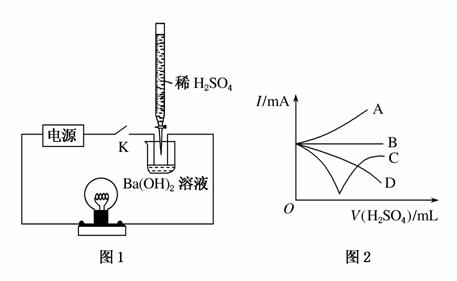
(1)该小组按图1连好装置后,接通开关K,旋转滴定管活塞使稀H2SO4缓缓滴下直至过量。图1装置中观察到的现象是______________________;能说明该反应是离子反应的依据是________。
(2)写出该反应的离子方程式____________________________。
(3)下列三种情况下,与(2)中离子方程式相同的是________。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO 恰好完全沉淀
恰好完全沉淀
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(4)上述(1)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的________曲线表示。(填曲线对应字母)
解析 (1)由于稀硫酸与氢氧化钡能发生反应生成硫酸钡白色沉淀,导致溶液中的离子浓度减小,溶液导电性减弱,加入过量稀硫酸时,溶液中H+和 SO
SO 浓度又逐渐增大,溶液的导电性又逐渐增强。(3)A、C项的离子方程式均为:Ba2++OH-+SO
浓度又逐渐增大,溶液的导电性又逐渐增强。(3)A、C项的离子方程式均为:Ba2++OH-+SO +H+===BaSO4↓+H2O,B项的离子方程式为Ba2++2OH-+SO
+H+===BaSO4↓+H2O,B项的离子方程式为Ba2++2OH-+SO +2H+===BaSO4↓+2H2O。(4)溶液的导电性先减弱后逐渐增强,故应为C曲线。
+2H+===BaSO4↓+2H2O。(4)溶液的导电性先减弱后逐渐增强,故应为C曲线。
答案 (1)烧杯中出现白色沉淀;灯泡由明变暗,然后又逐渐变亮 实验过程中灯泡的亮度发生变化,说明离子浓度发生变化,则该反应为离子反应
(2)Ba2++2OH-+SO +2H+===BaSO4↓+2H2O
+2H+===BaSO4↓+2H2O
(3)B (4)C


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
下列有关离子方程式与所述事实相符的是 ( )
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+==I2+2H2O
B.某溶液中存在大量Fe3+、S2ˉ、Clˉ、Na+,加入NaOH溶液发生反应:Fe3++3OHˉ=Fe(OH)3↓
C.向AlCl3溶液中投入过量的Na: Na+Al3++2H2O=Na++AlO2-+2H2↑
D.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
根据物质中N元素的化合价判断,下列说法错误的是( )
A.NH3具有还原性
B.N2既具有氧化性又具有还原性
C.N2只具有氧化性
D.HNO3具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子能大量共存的是( )
A.pH=12的溶液中:K+、Na+、Br-、AlO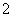
B.无色溶液中:H+、K+、MnO 、C2O
、C2O
C.c(Fe3+)=0.1 mol·L-1的溶液中:K+、H+、SCN-、I-
D.由水电离出的c(OH-)=1.0×10-13 mol·L-1的溶液中:Na+、NH 、SO
、SO 、HCO
、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.还原剂是S2-和Cu+,氧化剂是Fe3+
C.氧化产物是S,还原产物是Cu2+和Fe2+
D.当转移1 mol e-时,有46 g CuFeS2参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO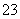 、NO
、NO 、SO
、SO 、SiO
、SiO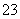 。现进行如下实验:
。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉 淀生成。
淀生成。
Ⅳ.向Ⅱ中所 得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水一定含有的离子是________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是___________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为14,其离子方程式为Al+NO +OH-―→AlO
+OH-―→AlO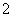 +NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO
+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO ,要消耗铝________g。
,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水,放出22.68 kJ热量,则该反应的热化学方程式为________________________________________。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,则该反应的热化学方程式为______________
______________________________________________________________。
(3)肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则肼燃烧的热化学方程式为______________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体
B.乙酸酸性较弱,不能使紫色石蕊试液变红
C.乙酸分子中含有碳氧双键,所以它能与溴发生加成反应使溴水褪色
D.酯化反应不属于取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com