
| A�������������ڼ���ͨ������N2O4����ƽ��������Ӧ�����ƶ� |
| B����ƽ��ʱ��NO2���������С��ԭƽ��ʱNO2��������� |
| C����ƽ��ʱ�������������ƽ����Է���������ԭƽ��� |
| D����ƽ��ʱ�����������ɫ��dz��������������ܶ����� |
| m |
| n |
| m |
| V |
| m |
| n |
| m |
| V |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��16g CH4���10NA������ |
| B��1mol?L-1NaCl��Һ����NA��Na+ |
| C��1mol Cu������ϡ���ᷴӦ����NA��NO���� |
| D�����³�ѹ�£�22.4L CO2�к���NA��CO2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��H2��D2��Ϊͬλ�� |
B��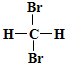 �� �� 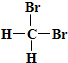 ��Ϊͬ���칹�� ��Ϊͬ���칹�� |
C��̼��Ϊ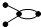 �� �� ����Ϊͬϵ�� ����Ϊͬϵ�� |
| D�����ʯ��ʯī��Ϊͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ʒ�� | �~�~�~�ƺ���ţ�ⷽ���� |
| ���� | С��ۡ�ţ�⡢ʳ�Ρ���ɰ�ǡ�ζ��������͡���ˮ���ܲ��� |
| ������ | 6���� |
| �������� | 2011��12��1�� |
| A�����������ʵ�������ţ�� |
| B��������֬������������� |
| C���˷����������Ѳ��ܰ�ȫʳ�� |
| D��С����и�����ѿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
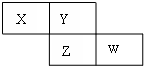 X��Y��Z��W���ֶ�����Ԫ�������ڱ���λ����ͼ��Yԭ�ӵ��������������������������3��������˵����ȷ���ǣ�������
X��Y��Z��W���ֶ�����Ԫ�������ڱ���λ����ͼ��Yԭ�ӵ��������������������������3��������˵����ȷ���ǣ�������| A����̬�⻯����ȶ��ԣ�X��Y |
| B��ZԪ�ص��������Ӧ��ˮ����һ����һ��ǿ�� |
| C��X��Y��Zԭ�Ӱ뾶�Ĵ�С˳��X��Y��Z |
| D��X����̬�⻯����W����̬�⻯��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��w��NaCl��=
| ||
B��n��NaCl��=
| ||
C��c��NaCl��=
| ||
D��n��NaCl��=
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������Ӧ |
| B������ȡ����Ӧ |
| C����ȥ�⣬��ȥ�ǻ� |
| D���ñ��͵��Ȼ�����Һ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Zn��s��+CuSO4��aq��=ZnSO4��aq��+Cu��s����H=-216kJ/mol ��Ӧ���������������������� |
| B��CaCO3��s��=CaO��s��+CO2��g����H=+178.5kJ/mol ��Ӧ���������������������� |
| C��101kPaʱ��2H2��g��+O2��g��=2H2O��l����H=-571.6kJ/mol H2��ȼ����Ϊ571.6kJ/mol |
| D��H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ/mol ��1molNaOH����Һ�뺬0.5molH2SO4��Ũ�����Ϻ�ų�57.3kJ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com