
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pHspan>=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
【答案】2H2O2 ![]() O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu
O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu ![]() 溶液中存在H2O2
溶液中存在H2O2![]() H+ +HO2-,HO2-
H+ +HO2-,HO2-![]() H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大 将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变 CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大 将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变 CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
【解析】
(1)由题意可知,在硫酸铜做催化剂作用下,双氧水分解生成水和氧气,反应的化学方程式为2H2O2 ![]() O2↑+2H2O,故答案为:2H2O2
O2↑+2H2O,故答案为:2H2O2 ![]() O2↑+2H2O;
O2↑+2H2O;
(2)①若Ⅲ中生成的沉淀为CuO2,说明双氧水与铜离子反应生成过氧化铜和水,反应的离子方程式为H2O2+Cu2+=CuO2↓+2H+,故答案为:H2O2+Cu2+=CuO2↓+2H+;
②由题意可知,过氧化铜能与溶液中氢离子反应生成双氧水,双氧水具有强氧化性,在酸性条件下可能会氧化氧化亚铜或铜,无法观察到红色沉淀,说明假设ⅱ可能成立,乙同学的观点正确,故答案为:CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu;
③a g过氧化铜的物质的量为![]() ,由方程式可得如下关系:CuO2—Cu2+—EDTA,则有
,由方程式可得如下关系:CuO2—Cu2+—EDTA,则有![]() = c mol/L×V×10—3L,解得V=
= c mol/L×V×10—3L,解得V=![]() ml,故答案为:
ml,故答案为:![]() ;
;
(3)由题意可知,双氧水溶液中存在如下电离平衡H2O2![]() H+ +HO2-、HO2-
H+ +HO2-、HO2-![]() H+ +O22-,溶液pH增大,氢离子浓度减小,两个平衡均正向移动,过氧根浓度增大,使得过氧化铜沉淀量增大,故答案为:溶液中存在H2O2
H+ +O22-,溶液pH增大,氢离子浓度减小,两个平衡均正向移动,过氧根浓度增大,使得过氧化铜沉淀量增大,故答案为:溶液中存在H2O2![]() H+ +HO2-,HO2-
H+ +HO2-,HO2-![]() H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大;
H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大;
(4)若过氧化铜能够催化过氧化氢分解,过氧化氢分解速率加快,催化剂过氧化铜的组成和质量不会发生变化,则实验操作和现象为将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变,故答案为:将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变;
(5)由以上实验可知,当溶液pH增大时,双氧水溶液中过氧根浓度增大,使得过氧化铜沉淀量增大,过氧化铜的催化能力强于铜离子,使双氧水的分解速率增大,故答案为:CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是_____(填序号,下同),互为同系物的是_____,互为同分异构体的是_____。
①红磷与白磷 ②35Cl与37Cl ③CH3COOCH3与CH3CH2COOCH3④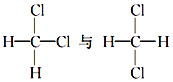 ⑤
⑤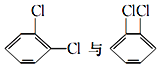 ⑥
⑥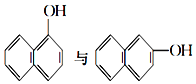 ⑦乙醇与二甲醚
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2:_____。
②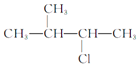 _____
_____
③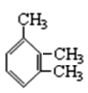 _____
_____
(3)写出下列有机反应的方程式:
①1,3-丁二烯的加聚反应:_____
②3-甲基-2-丁醇的催化氧化反应:_____
③甲醛与新制氢氧化铜反应:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
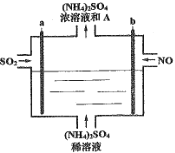
A.a与电源负极相连,发生还原反应
B.每处理lmolNO可以生成2molA
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2:5通入装置可彻底转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
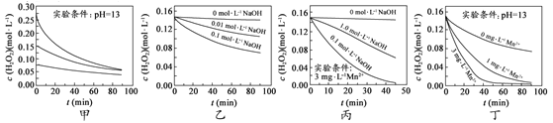
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com