
| A. | 1L pH=1的乙酸溶液中H+数小于0.1NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 28g乙烯和丙烯所含碳氢键的数目为4NA | |
| D. | 1 mol 甲基所含的电子数为10NA |
分析 A.pH=1的溶液中乙酸氢离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢离子;
B.标准状况下,乙醇的状态不是气体;
C.乙烯和丙烯的最简式为CH2,根据最简式进行计算含有H原子的物质的量,从而得出形成碳氢键的物质的量;
D.甲基为中性原子团,甲基中含有9个电子.
解答 解:A.1L pH=1的乙酸溶液中含有氢离子的物质的量为:0.1mol/L×1L=0.1mol,该溶液中H+数为0.1NA,故A错误;
B.标况下乙醇不是气体,不能使用标况下的气体摩尔体积计算,故B错误;
C.28g乙烯和丙烯的混合气体中含有28个最简式CH2,含有最简式的物质的量为:$\frac{28g}{14g/mol}$=2mol,2mol最简式中含有4molH原子,则含有碳氢键的物质的量为4mol,每个氢原子形成1个碳氢键,则混合物中所含碳氢键的数目为4NA,故C正确;
D.1mol甲基中含有9mol电子,所含的电子数为9NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,B为易错点,注意标况下乙醇不是气体.


科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 原混合酸中NO3- 物质的量为0.1 mol | |
| D. | H2SO4 浓度为2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 | |
| B. | 水加热到很高的温度都难以分解,主要原因是水分子间可以形成氢键的缘故 | |
| C. | 增大反应物浓度,可增大单位体积内活化分子数,使单位时间内有效碰撞次数增加 | |
| D. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | NH3 | C. | HCHO | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式:N??N | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: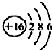 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe3++SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,若电解5min时铜电极增重2.16g,试回答:
如图所示,若电解5min时铜电极增重2.16g,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com