
Ⅰ.请回答:
(1)燃着的钠不能用CO2灭火,其理由 (用化学方程式表示)。
(2)完成以下氧化还原反应的离子方程式:
( )Fe3++( )ClO-+______=( )FeO42-+( )Cl-+( )H2O
(3)剧毒物氰化钠的电子式为 ,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
II.化合物A是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
A(s)+H2(g)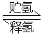 B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4.48L气体D (已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色。
(1)A的化学式为 ,LiH中r(Li+) r(H-)(填“大于”或“小于”)。
(2)写出液氨与金属锂反应的化学方程式 。
(3)B在加强热时生成NH3和另一种化合物E,该分解反应的化学方程式为 。
(4)化合物E也可以作储氢材料,其储氢原理可表示为:
E(s)+H2(g) A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
储氢材料可以通过加热的方式释放氢气。从实用化角度考虑,选择 (填“A”或“E”)作储氢材料更合理,理由是 。
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高二上12月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
①化石燃料在任何条件下都能充分燃烧
②化石燃料在燃烧过程中能产生污染环境的CO、SO 2 等有害气体
③直接燃烧煤不如将煤进行深加工后再燃烧效果好
④固体煤变为气体燃料后,燃烧效率将更低
A.①④ B.②③④ C.②③ D.①③④
查看答案和解析>>
科目:高中化学 来源:2016届福建省闽粤联合体高三上学期第三次联考化学试卷(解析版) 题型:选择题
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B. FeSO4 C. Fe(NO3)2 D、Fe3O4
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:推断题
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8 kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H=+180 kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
(6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期末热身理综化学试卷(解析版) 题型:选择题
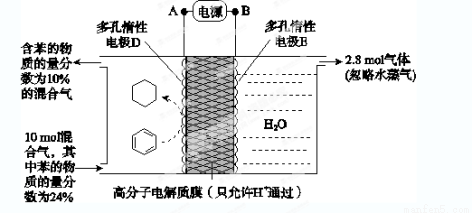
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
A.X、Y、Z一定都是非金属单质
B.X、Y、Z一定都是金属单质
C.X、Y、Z中至少有一种是非金属单质
D.X、Y、Z中至少有一种是金属单质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:填空题
下图所示为含Cr化合物在一定条件下的转化:
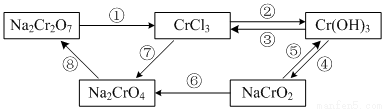
(1)①~⑧所示转化中,需要加入氧化剂才能实现的是_______(填写序号)。
(2)在上述转化中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)转化①可通过下列反应实现:
①完成并配平的化学方程式:
__Na2Cr2O7+__KI+__H2SO4——__Cr2(SO4)3+__Na2SO4+__K2SO4+__I2+__H2O
②用单线桥表示电子转移的方向和数目
③反应中每转移0.4mol电子,生成I2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:计算题
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e- △H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g) △H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
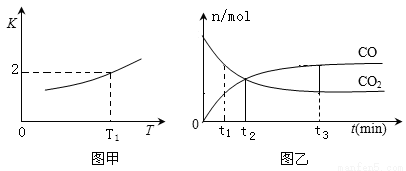
①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | 同种物质的体积分数相同 |
乙 | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 | |
起始时乙容器中的压强是甲容器的____倍。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
下列关于容量瓶的四种叙述:①是配制准确物质的量浓度的溶液的仪器;②不易储存溶液;
③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是
A.①②③④ B.②③ C.①②④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是

A.转移溶液 B.除去氯气中氯化氢 C.点燃 D.称量NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com