
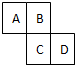
 如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.
如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.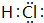 ,A单质为N2,分子中N原子之间形成3对共用电子对,电子式为
,A单质为N2,分子中N原子之间形成3对共用电子对,电子式为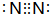 ,
,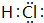 ;
;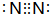 .
.


科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3消耗的盐酸多 |
| B、NaHCO3放出的CO2多 |
| C、Na2CO3放出的CO2多 |
| D、NaHCO3消耗的盐酸多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、I-、NO3-、SiO32- |
| B、K+、Na+、NO3-、MnO4- |
| C、Ag+、Fe3+、Cl-、SO42- |
| D、NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com