
| A、铜的硫化物具有氧化性 |
| B、CuS的溶解度大于ZnS的溶解度 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D、以上过程涉及到了氧化还原反应和复分解反应 |


科目:高中化学 来源: 题型:
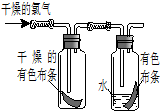 (1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是查看答案和解析>>
科目:高中化学 来源: 题型:
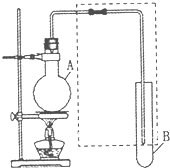 如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s22p63s23p63d54s1 |
| B、1s22s22p63s23p3 |
| C、1s22s22p63s23p63d64s2 |
| D、1s22s22p63s23p63d74s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、IA族 | B、ⅡA族 |
| C、ⅢA族 | D、IVA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com