
【题目】按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4___________
(NH4)2CO3_______________
NaHCO3_____________________
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是__(填序号,下同);属于电解质的是_______;属于非电解质的是_____
【答案】NaHSO4= Na++H++SO![]() (NH4)2CO3=2NH
(NH4)2CO3=2NH![]() +CO
+CO![]() NaHCO3= Na++HCO
NaHCO3= Na++HCO![]() ①④⑨ ③⑤⑦⑧ ②⑥⑩
①④⑨ ③⑤⑦⑧ ②⑥⑩
【解析】
电解质是指在水溶液或熔融条件下能导电的化合物;非电解质是指在水溶液和熔融条件下都不能导电的化合物。
(1) 硫酸为强酸,NaHSO4电离方程式为:NaHSO4= Na++H++SO![]() ;
;
(NH4)2CO3为盐,电离方程式为:(NH4)2CO3=2NH![]() +CO
+CO![]() ;
;
碳酸为弱酸, NaHCO3电离方程式为:NaHCO3= Na++HCO![]() ;
;
(2)①NaCl溶液,存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;②干冰,无自由移动的离子或电子,不能导电,是非电解质;③ 液态HCl,无自由移动的离子或电子,不能导电,在水溶液中能导电,是电解质; ④铜有自由移动电子,能导电,属于单质,既不是电解质也不是非电解质;⑤BaSO4固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑥ 蔗糖,无自由移动的离子或电子,不能导电,是非电解质;⑦Na2O,有离子,但是离子不能自由移动,不能导电,是电解质;⑧NaOH固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑨盐酸存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;⑩NH3 ,无自由移动的离子或电子,不能导电,是非电解质;
其中能够导电的是①④⑨;属于电解质的是③⑤⑦⑧;属于非电解质的是②⑥⑩。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL![]() 的HR溶液中逐滴滴入
的HR溶液中逐滴滴入![]() 的
的![]() 溶液,所得溶液pH及导电能力变化如图
溶液,所得溶液pH及导电能力变化如图![]() 下列分析不正确的是
下列分析不正确的是![]()
![]()
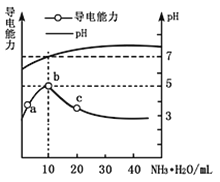
A. ![]() 点导电能力增强,说明HR为弱酸
点导电能力增强,说明HR为弱酸
B. b点溶液![]() ,此时酸碱恰好中和
,此时酸碱恰好中和
C. c点溶液存在![]() 、
、![]()
D. b、c两点水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
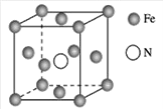
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
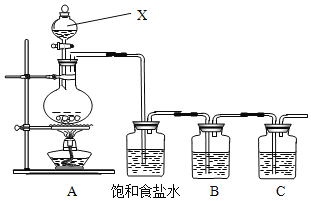
(1)请写出A装置中发生反应的化学方程式___。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是___(选填下列所给试剂的编号),反应离子方程式是__。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:______________________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④HCl酸性比H2S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3![]() HCO3-+ Na+
HCO3-+ Na+
B. NaHSO4:NaHSO4=Na+ +HSO4-
C. CH3COONH4:CH3COONH4=NH4++CH3COO-
D. Fe(OH)3:Fe(OH)3![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是
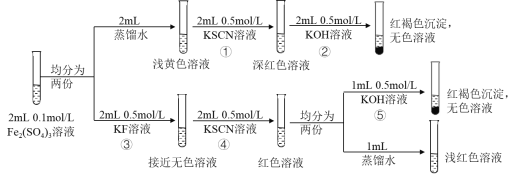
A.FeF3是弱电解质
B.④中发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-
C.相同条件下,结合Fe3+的能力:SCN->F->OH-
D.向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.6NA
C.11克D218O中含有的中子数为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T型化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是( )
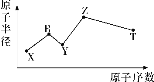
A.原子半径和离子半径均满足:Y<Z
B.简单氢化物的沸点和热稳定性均满足:Y>T
C.最高价氧化物对应的水化物的酸性:T<R
D.常温下,0.1mol·L-1由X、Y、Z、T四种元素组成的化合物的水溶液的pH一定大于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com