
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )
A.C(s)+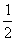 O2(g)====CO(g);ΔH=-393.5 kJ·mol-1
O2(g)====CO(g);ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(g);ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
D.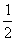 C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程:
 |
请回答以下问题:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,
得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)工业上在500℃左右使用铁触媒作为催化剂合成NH3,
①铁触媒中含有Fe3+,,则Fe3+的核外电子排布式为
②500℃时,合成塔中的反应为:N2(g)+3H2(g)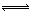 2NH3(g) ∆H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。
2NH3(g) ∆H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。
 |
(3)沉淀池中反应的化学方程式为
(4)在上述流程中可以循环使用的X是 (填化学式),从(NH4)2SO4溶液中获得
(NH4)2SO4晶体操作的步骤是是加热浓缩、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质组成、分类正确的是
A.盐酸、硫酸、硝酸都是强氧化性酸
B.新制氯水的溶质主要是次氯酸分子
C.纯碱、烧碱的成分分别是碳酸钠、氢氧化钠
D.苯、聚苯乙烯、聚乙烯的组成元素以及元素质量比相等
查看答案和解析>>
科目:高中化学 来源: 题型:
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4  Mgx Mo3S4 。下列说法错误的是( )
Mgx Mo3S4 。下列说法错误的是( )
A.放电时Mg2+向正极迁移 B.充电时阳极反应为:Mo3S42x-—2xe- =Mo3S4
C.充电时Mo3S4发生氧化反应 D.放电时负极反应为:xMg - 2xe- = xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。
装置A中发生反应的化学方程式为___________________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后, 经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。 过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准 溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液,同时开始反应,出现浑浊最早的是
A.20℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合
B.20℃时 50mL 0.1mol·L-1 Na2S2O3溶液与50mL 0.1mol·L-1硫酸混合
C.10℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合
D.10℃时 5mL 0.1mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。 已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ/mol,
则表示肼跟N2O4反应的热化学方程式
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见物质A、B、C、D、E、X,存在图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 



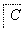


A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
B、若D是一种强碱,则A、B、C均可与X反应生成D
C、若D为NaCl,且A可与C反应生成B,则E可能是CO2
D、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。

接通电源,经过一端时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
(3) 若电解后甲溶液的体积为25L,且产生的气体全部逸出。该溶液常温时的pH为 。
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com