
��һ�������������Ժ�CO2������Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g) ��H>0��
FeO(s)+CO(g) ��H>0��
(1)���д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� (�����)��
A.�����¶� B.����ѹǿ
C.����һ�������� D.�ټ���һЩ����
(2)��Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2��ʹCO2��Ũ�ȳ�Ϊԭ����2������CO2��ת���ʽ� (���������С�����䡱)��
����һ���¶��µ�ij�ݻ��ɱ���ܱ������У��������л�ѧƽ�⣺C(s)+H2O(g)  CO(g)+H2(g)���Է����ͻش��������⣺
CO(g)+H2(g)���Է����ͻش��������⣺
(1)���϶��������淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���� (ѡ�����)��
A����ϵ��ѹǿ���ٷ����仯
B��v��(CO)=v��(H2O)
C������n mol CO��ͬʱ����n mol H2
D��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
(2)��������ѧƽ��״̬������Ӧ��ʼ�������ﵽƽ���ƽ����ϵ��ѹ(��С�ݻ���������������)���������������ƽ����Է��������� (��д�����䡱������С�����)��
 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Һ����������������ش���������
��1��һ�����������ܱ������з�����Ӧ��
a��NH4I(s)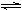 NH3(g) + HI(g) b��2HI(g)
NH3(g) + HI(g) b��2HI(g) 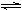 H2(g) + I2(g)
H2(g) + I2(g)
��д����Ӧa��ƽ�ⳣ������ʽ
�ڴﵽƽ������������������Ӧb���ƶ����� ��������������ƶ��������ﵽ�µ�ƽ��ʱ��������ɫ�������仯 ������������dz�����䡱��
��2����ҵ�Ϻϳɰ��ķ�Ӧ��N2(g)��3H2(g) 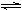 2NH3(g) ��H����92.60 kJ��mol��1
2NH3(g) ��H����92.60 kJ��mol��1
����˵����˵��������Ӧ������Ӧ������е���________(�����)��
a����λʱ��������2n mol NH3��ͬʱ����3n mol H2
b����λʱ��������6n mol N��H����ͬʱ����2n mol H��H��
c����N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
d����������ƽ��Ħ����������
e�������ڵ������ܶȲ���
��3����֪�ϳɰ���Ӧ��ij�¶���2 L���ܱ������н��У�����������ݣ�
| ʱ��(h) ���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ʵ�����A��B�����2 L���ܱ������У��������·�Ӧ��3A��g����B��g�� xC��g����2D��g������5min���D��Ũ��Ϊ0.5mol/L��c��A����c��B����3��5��C��ƽ����Ӧ����Ϊ0.1mol/��L��min������
xC��g����2D��g������5min���D��Ũ��Ϊ0.5mol/L��c��A����c��B����3��5��C��ƽ����Ӧ����Ϊ0.1mol/��L��min������
��1����ʱA��Ũ��c��A����________mol/L����Ӧ��ʼǰ�����е�A��B�����ʵ�����n��A����n��B����________mol��
��2��B��ƽ����Ӧ���ʣ�v��B����________mol/��L��min����
��3��x��ֵΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
úֱ��ȼ�յ����������ʽϵͣ�Ϊ����������ʣ���ҵ�Ͻ�ú����(ת���CO��H2)���ٺϳ��Ҵ��������ѵȶ�����Դ��
(1)��ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ������� ���������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⡣�õ�صĸ�����ӦʽΪ______________________��
(2)ú����������������ڹ�ҵ�ϳɶ����ѣ��䷴Ӧ���£�
2CO(g)��4H2(g) CH3OCH3(g)��H2O(g)��
CH3OCH3(g)��H2O(g)��
ͬʱ��������Ӧ��CO(g)��2H2(g) CH3OH(g)��CO(g)��H2O(g)??CO2(g)��H2(g)��
CH3OH(g)��CO(g)��H2O(g)??CO2(g)��H2(g)��
���¶�Ϊ250 �桢ѹǿΪ3.0 MPaʱ��ij������Ͷ�ϱ�V(H2)��V(CO) ��a����������ƽ��ʱ��Ӧ��ϵ�и���ֵ�����������±���
| ���� | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
| ������� | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
 CO2(g)��H2(g)��ƽ�ⳣ��K��________��
CO2(g)��H2(g)��ƽ�ⳣ��K��________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶���2 L�ĺ�����������,����2 mol̼��2 mol CO2�������·�Ӧ: C(s)+CO2(g)  2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��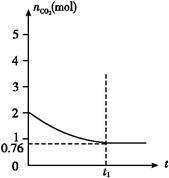
(1)�÷�Ӧ�Ħ�S����0(�>������<����=��)������������(��ϸߡ��ϵ͡�)�¶��������ڸ÷�Ӧ�Է����С�
(2)��ʽ�����������¶��´˷�Ӧ��ƽ�ⳣ������������������������(�������һλС��)��
(3)������ƽ����ϵ����ͨ��CO2,��CO2��ת������������(���������С���������䡱����ȷ����)��
(4)��ͬ�¶���,2 L�ĺ����������м���4 mol̼��4 mol CO2,�ﵽƽ�⡣����ͼ�л�����������CO2�����ʵ�����ʱ��t�仯��ϵ��Ԥ�ڽ��ʾ��ͼ��(ע��ƽ��ʱCO2�����ʵ���)
(5)��ͬ�¶���,2 L�ĺ����������м���4 mol̼��4 mol CO2��4 mol CO����ʼ��Ӧʱv���������� v��(�>������<����=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����β���к���CO��NO2���ж�����,��������װβ������װ��,��ʹ�ж��������Ӧת��Ϊ�����塣����β����CO��NO2������һ�������¿��Է�����Ӧ:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ��H="-1" 200 kJ��mol-1
4CO2(g)+N2(g) ��H="-1" 200 kJ��mol-1
(1)���º���������,����˵���÷�Ӧ�Ѵﵽƽ��״̬���� (����ĸ,��ͬ)��
A.�����ڻ��������ɫ���ٱ仯
B.�����ڵ�ѹǿ���ֲ���
C.2v(NO2)��=v(N2)��
D.�����ڻ�������ܶȱ��ֲ���
(2)��ʹ�÷�Ӧ�ķ�Ӧ��������,��ƽ�����淴Ӧ�����ƶ����� ��
A.��ʱ�����CO2
B.�ʵ������¶�
C.��С�������ʹ��ϵѹǿ����
D.ѡ���Ч����
(3)���ڸ÷�Ӧ,�¶Ȳ�ͬ(T2��T1)������������ͬʱ,����ͼ����ȷ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��  2NH3��g����CO2��g��
2NH3��g����CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹ ǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ��/mol�� L��1 | 2.4�� 10��3 | 3.4�� 10��3 | 4.8�� 10��3 | 6.8�� 10��3 | 9.4�� 10��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�á��Իش��������⣺
(1)��¯������CO�������Ҫ��;֮һ���������ӦΪ��FeO(s)��CO(g) Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��ʱƽ�ⳣ��Kֵ (���������С�����䡱)��
��1 100 ��ʱ��ø�¯�У�c(CO2)="0.025" mol��L-1��c(CO)="0.1" mol��L-1��������������£��÷�Ӧ�� ����(����ҡ�)���ж������� ��
(2)Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״����йط�ӦΪ��CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��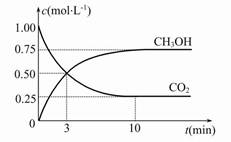
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)�� ��
�ڷ�Ӧ�ﵽƽ������д�ʩ��ʹ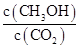 ������� (�����)��
������� (�����)��
| A�������¶� | B���ٳ���H2 | C���ٳ���CO2 | D����H2O(g)����ϵ�з��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£���2L�ܱ�������NO2��O2�ɷ������з�Ӧ�� 4NO2(g)+O2(g)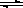 2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com