
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式 ;其中含有的化学键是 。
(2)用电子式表示Y2O的形成过程_______________________。
(3)X、Z、W三种元素的最高氧化物对应的水化物只,稀溶液氧化性最强的是____________(填写化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是 (填写化学式)。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__________________。
【答案】(1)![]() (2分);离子键、共价键(2分);
(2分);离子键、共价键(2分);
(2)![]() ;(2分)
;(2分)
(3)HNO3(1分);(4)NH3(1分);(5)NCl3+3H2O=3HClO(g)+NH3(g)
【解析】试题分析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物,所以Y是Na,则X是N,Z是S,W是Cl。
(1)过氧化钠是离子化合物,其电子式为![]() ,其中含有的化学键是离子键和共价键。
,其中含有的化学键是离子键和共价键。
(2)氧化钠是离子化合物,其形成过程为![]() 。
。
(3)X、Z、W三种元素的最高氧化物对应的水化物中稀溶液氧化性最强的是硝酸,化学式为HNO3。
(4)XH3、H2Z和HW三种化合物中氨气是碱性气体,可与H2S和HCl反应生成铵盐。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,化学式为NCl3,该化合物遇水可生成一种具有漂白性的化合物,根据原子守恒可知该化合物是次氯酸,所以反应的化学方程式为NCl3+3H2O=3HClO(g)+NH3(g)。


科目:高中化学 来源: 题型:
【题目】汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的.
(1)若气囊中装有130g NaN3,则其物质的量是__________.
(2)若130g NaN3完全分解,在标准状况下,气囊膨胀的体积约为__________.
(3)该反应中的氧化剂是 氧化产物是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中部分短周期元素,其中Y原子最外层电子数是其电子层数的2倍。下列说法正确的是( )
R | ||
X | Y | Z |
A.Y的氢化物比Z的氢化物稳定
B.原子半径大小顺序是X>Y>R
C.Y、R形成的化合物YR3能使酸性KMnO4溶液褪色
D.四种元素中最高价氧化物对应的水化物酸性最强的是Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a g气体A与b g气体B的物质的量相同,则下列说法中错误的
A.A与B两种气体的相对分子质量之比为a:b
B.同质量的A、B两种气体分子数之比为b:a
C.同温同压时,两种气体A与B的密度之比为a:b
D.同温同体积时,同质量的A、B两种气体的压强之比为a:b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法正确的是( )
A.化学键断裂需要吸收能量
B.化学反应中能量变化的大小与反应物的质量多少无关
C.在化学反应过程中反应物的总能量总是等于生成物的总能量
D.放热反应都能自发进行,吸热反应需要在加热的条件下才能进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
依据上表数据列式计算该NaOH溶液的物质的量浓度为_____________ mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列画有横线的物质在反应中不能完全消耗的是
A.将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃
B.将l mol Mg置于10 L空气(标况)中,使之在高温下反应
C.标准状况下,将11.2L H2S与22.4L O2混合点燃
D.在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
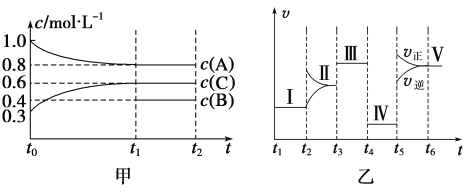
(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=___________。
(2)t4时刻改变的条件为____________,B的起始物质的量为______________。
(3)t5时刻改变的条件为_____________,该反应的逆反应为__________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com