
【题目】下列状态的物质,既能导电又属于电解质的是( )
A.液态氯化氢
B.NaCl晶体
C.熔融的KNO3
D.CuSO4溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】把单质铁加入氯化铜、氯化亚铁、氯化铁和盐酸混合溶液中,反应后铁有剩余,则溶液中浓度最大的阳离子是( )
A. Cu2+ B. Fe2+ C. Fe3+ D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其它条件一定时,图中曲线表示反应2NO(g)+ O2(g) ![]() 2NO2(g) △H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
2NO2(g) △H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
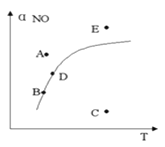
A.A点反应未达到平衡状态,且反应正向移动
B.C点NO转化率最低,且化学反应速率最小
C.B、D两点均处于相应温度下的化学平衡状态,且αB(NO)<αD(NO)
D.E点反应未达平衡,反应正向移动,容器内压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2﹣和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1![]() 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1![]() 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1![]() 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与![]() 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某校化学兴趣小组同学根据实验测得的我市市区不同地区空气中SO2含量:
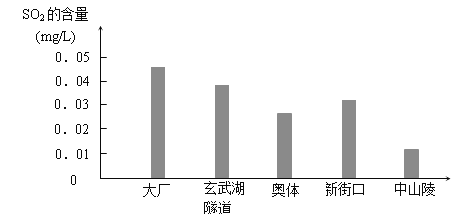
⑴大厂、玄武湖隧道SO2含量明显高于其他地区的原因是 。
⑵请你向缪瑞林市长分别提出一条降低这两个地区SO2含量的建议 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B. NH4HCO3溶于过量的NaOH溶液中:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. MnO2与浓盐酸反应制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250℃时,以镍合金为催化剂,向4 L的恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
(1)已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1
II.CO(g)+H2O(g)=CO2(g)+H2(g)△H2
III.2CO(g)+O2(g)=2CO2(g)△H3
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H= (用含△H1,△H2和△H3的代数式表示)。
2CO(g)+2H2(g)的△H= (用含△H1,△H2和△H3的代数式表示)。
(2)此温度下,该反应的平衡常数K的值为 。
(3)此温度下,若测得某时刻各物质的浓度均为1.0 mol·L-1,此时反应正在向 进行。(选填“正反应方向”或“逆反应方向”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com