
 C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
 ①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
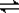 ?CO(g)+H2(g), CO(g)+H2O(g)?
?CO(g)+H2(g), CO(g)+H2O(g)?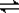 ?CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
?CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )| A.0.1 mol/L | B.0.9 mol/L |
| C.1.8 mol/L | D.1.9 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4Y(g) +Z(g) △H < 0,在某温度时X的浓度随时间变化的曲线:
4Y(g) +Z(g) △H < 0,在某温度时X的浓度随时间变化的曲线: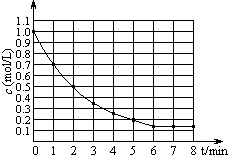
| A.第6min后,反应就终止了 |
| B.X的平衡转化率为85% |
| C.若升高温度,X的平衡转化率将大于85% |
| D.若降低温度,v正和v逆将以同样倍数减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )
C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )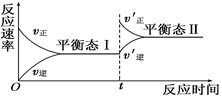
| A.平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 |
| B.平衡移动的原因可能是增大了反应物浓度 |
| C.平衡移动的原因可能是增大了压强 |
| D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1<K2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ,下列叙述中是反应达到平衡的标志的是( )
2C(g) ,下列叙述中是反应达到平衡的标志的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g) + NO (g)(正反应为放热反应),达到平衡后,只改变其中一个条件,对平衡的影响是:(填“向左”、“向右”、“不移动”或颜色“变深”、“变浅”或“不变化”)
CO2 (g) + NO (g)(正反应为放热反应),达到平衡后,只改变其中一个条件,对平衡的影响是:(填“向左”、“向右”、“不移动”或颜色“变深”、“变浅”或“不变化”)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 N2O4(g)△H<0。
N2O4(g)△H<0。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: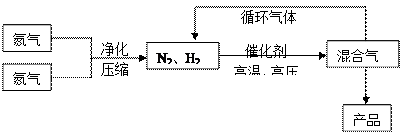
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com