
【题目】下列叙述正确的是( )
A.胶体区别于其他分散系的根本原因是胶体有丁达尔现象
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液
C.光束通过胶体和浊液时都可以看到一条光亮的通路,而溶液不能
D.胶体的分散质可以通过过滤从分散剂中分离出来
科目:高中化学 来源: 题型:
【题目】已知在25℃的水溶液中,AgCl、AgBr、AgI均难溶于水,且Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=1.0×10-12,Ksp(AgI)=8.7×10-17;
(1)若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)_______________。(填“增大”、“减小”或“不变”)。
(2)在25℃时,若取0.188g的AgBr(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为_____________。
(3)①由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化_______(填“能”或“否”),简述理由:_____________________________________________________________。
②若某KCl溶液的浓度为1.0×10-2mol·L-1,将等体积的该KCl溶液与AgNO3溶液混合,则生成沉淀所需AgNO3溶液的最小浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含大量NH4+、Na+、HCO3-、CO32-、CH3COO-离子,其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
A. Na+ B. CO32-、NH4+
C. CH3COO- D. CH3COO-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁矿(主要成分为Mg2B2O5·H2O)与硫酸反应可制备硼酸(H3BO3),下列措施能增大该反应速率的是( )
A. 增加反应时间 B. 降低反应温度
C. 减小H2SO4浓度 D. 减小硼镁矿颗粒粒度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是()。
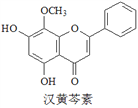
A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在海水中主要以I-的形式存在,在地壳中和生活中主要以NaIO3的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )

A. 由图可知氧化性的强弱顺序为Cl2>I2>IO![]()
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O===2HIO3+10HCl
C. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
D. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 k J·mol1
2NO(g) ΔH=+180.5 k J·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 k J·mol1
2NO2(g) ΔH=116.5 k J·mol1
回答下列问题:
(1)CO的燃烧热为_________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为___________kJ。
(2)CO将NO2还原为单质的热化学方程式为_______。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.28 | 2.75 | 2.70 | 2.70 |
①前2 s内的平均反应速率v(N2)=___________,此温度下,该反应的平衡常数K=________。
②能说明上述反应达到平衡状态的是_________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因是___________ ,图中压强(p1,p2、p3)的大小顺序为_________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感光性高分子作为新材料在各种领域中得到广泛应用。感光高分子F的一种合成路线如下:

已知:
A的相对分子质量为60,氧元素的质量分数为0.533,核磁共振氢谱显示为两组峰,峰面积比为1∶3。
回答下列问题:
(1)A的结构简式为____________,D的化学名称是____________。
(2)①、②的反应类型分别是____________、____________。
(3)反应③的化学方程式是_____________。
(4)F中的官能团有______________(填官能团名称)。
(5)芳香族化合物G是E的同分异构体,能发生银镜反应且分子中只有4种不同化学环境的氢。写出三种G的结构简式:______________。
(6)写出以甲苯为原料(其他无机试剂任选)制备化合物D的合成路线(箭头上方标试剂,下方标条件)。
__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com