
分析 根据n=$\frac{V}{{V}_{m}}$计算生成的二氧化碳的物质的量,设原混合物中Na2CO3、NaHCO3的物质的量分别为xmol、ymol,根据方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,用x、y表示各自生成的二氧化碳的物质的量、消耗HCl的物质的量,利用二者消耗的HCl和与生成的二氧化碳的物质的量列方程计算.
解答 解:标准状况22.4L二氧化碳的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
消耗HCl的物质的量=0.1L×3mol/L=0.3mol,
设原混合物中Na2CO3、NaHCO3的物质的量分别为xmol、ymol,则:
Na2CO3+2HCl=2NaCl+CO2↑+H2O,
xmol 2xmol xmol
NaHCO3+HCl=NaCl+CO2↑+H2O
ymol ymol ymol
所以:$\left\{\begin{array}{l}{2x+y=0.3}\\{x+y=0.2}\end{array}\right.$,
解得:x=0.1、y=0.1,
答:混合物中Na2CO3的物质的量为0.1mol.
点评 本题考查混合物的有关计算,题目难度不大,注意根据方程式的计算方法,明确反应原理是解题的关键,试题培养了学生的分析能力及化学计算能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2是形成酸雨的主要物质 | |
| B. | CO2导致温室效应,是一种大气污染物 | |
| C. | CO2(g)+C(s)$\stackrel{高温}{?}$2CO(g)△H>0,高温有利于该反应自发进行 | |
| D. | 实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氧化氢溶掖的试管内加入肝或沙子.在这个实验中,试管A放氧相对缓慢,试管C和D不放氧.请问答下列问题:
氧化氢溶掖的试管内加入肝或沙子.在这个实验中,试管A放氧相对缓慢,试管C和D不放氧.请问答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤①② | B. | ①②⑤③④ | C. | ⑤④③②① | D. | ③④⑤②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
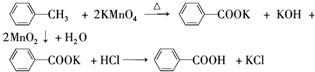
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
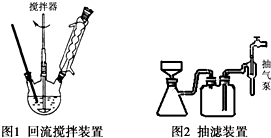
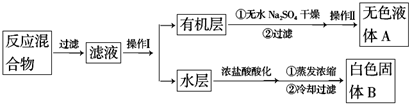
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取粗硅的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| B. | 硫酸型酸雨的形成会涉及反应2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| C. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2: 2ClO-+CO2+H2O=2HClO+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com