
【题目】下列反应属于吸热反应的是( )
A.石灰石在高温下的分解反应
B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应
D.木炭在氧气中燃烧
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】右图曲线a表示放热反应X(g)+Y(g)![]() Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是

A. 加催化剂 B. 只加大X的投入量
C. 升高温度 D. 增大容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油的催化重整可以得到芳香烃,说明石油中含有芳香烃
B. 石油裂解的主要目的是提高汽油等轻质油的产量
C. 石油分馏得到的各馏分是混合物
D. 石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.金属钠着火时,用细沙覆盖灭火
B.化学危险品标志上的数字表示的是危险等级
C.蒸馏实验结束后,先停止通冷凝水,再停止加热
D.焰色实验所用的铂丝,每次用完后都要用蒸馏水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态Mn原子的价电子排布式为___________。
(2)现代化学中,常利用_______________________上的特征谱线来鉴定元素。
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为__________;上述反应每生成1molMnO4-,S2O82-断裂的共价键类型及其数目为_____________________;与硫酸根等电子体的分子或离子有______________________(写两种)。

(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为___________;实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是_________________。

(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为_____________(填最简整数比);已知该晶体的密度为d g/cm3,阿伏伽德罗常数的值为NA,则晶胞参数a为_________nm (用含d和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化过程中,有共价键明显被破坏的是( )
A.I2升华B.NaCl颗粒被粉碎
C.盐酸和NaOH溶液混合D.从NH4HCO3中闻到了刺激性气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹(At)是卤族元素中位于碘后面的元素,推测砹和砹的化合物最不可能具备的性质( )
A.砹易溶于某些有机溶剂
B.砹化氢很稳定不易分解
C.砹是有色固体
D.砹化银不溶于水或稀HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mol氩气在标准状况下的体积约为11.2 L
B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA
C. 标准状况下,11.2 L H2CO3含有的原子数为3NA
D. 常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。
(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
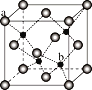
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com