C
分析:A、依据气体摩尔体积的应用条件分析判断;
B、从随反应进行盐酸浓度减小到一定程度,不再和二氧化锰反应生成氯气分析;
C、质量换算为物质的量结合分子构成计算原子数目;
D、从铵根离子能发生水解分析判断;
解答:A、常温常压下,22.4 L氯气物质的量不一定是1mol,故A错误;
B、8.7g MnO
2物质的量为0.1mol,40mL10mol/L的浓盐酸物质的量为4mol,按照化学方程式中的反应比应恰好反应,但浓盐酸在反应过程中浓度逐渐减小,当为稀盐酸时不再和二氧化锰反应生成氯气,所以生成的氯气分子数小于0.1N
A,故B错误;
C、21g氧气物质的量=
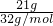
=
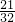
mol;含氧原子
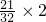
=
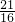
mol;27g臭氧物质的量=
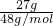
=
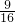
mol,含氧原子为
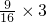
=
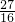
mol,所以21g氧气和27g臭氧所含氧原子总数=
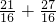
=3mol,即3N
A,故C正确;
D、500mL 1.0 mol?L
-1的NH
4Cl溶液中铵根离子物质的量为0.5mol,由于铵根离子水解,所以含有NH
4+数目小于0.5 N
A,故D错误;
故选C.
点评:本题考查了气体摩尔体积的应用条件,化学方程式的计算中浓度的减小影响反应的产物生成,质量换算物质的量,结合分子式计算原子总数,盐类水解的应用.

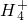 的数目为0.5 NA
的数目为0.5 NA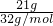 =
=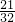 mol;含氧原子
mol;含氧原子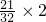 =
=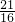 mol;27g臭氧物质的量=
mol;27g臭氧物质的量=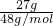 =
=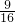 mol,含氧原子为
mol,含氧原子为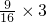 =
=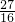 mol,所以21g氧气和27g臭氧所含氧原子总数=
mol,所以21g氧气和27g臭氧所含氧原子总数=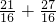 =3mol,即3NA,故C正确;
=3mol,即3NA,故C正确;

 智能训练练测考系列答案
智能训练练测考系列答案