
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
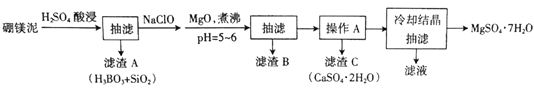
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。
【答案】 适当增加硫酸浓度、提高反应温度、搅拌等 (任写两条,答案合理即可) Na2B4O2+H2SO4+5H2O=Na2SO4+4H3BO3↓ ClO-+Mn2++H2O=MnO2↓+Cl-+2H+ 使Fe、Al转化为氢氧化物沉淀除去 蒸发结晶 趁热过滤 过滤速度快,得到的沉淀较干燥 70%
【解析】(1)为提高酸浸时浸出速率,可采取的措施有适当增加硫酸浓度、提高反应温度、搅拌等;正确答案:适当增加硫酸浓度、提高反应温度、搅拌等 (任写两条,答案合理即可)。
(2)根据反应的流程可知,H2SO4和Na2B4O7发生反应生成H3BO3沉淀和硫酸钠,化学方程式为Na2B4O2+H2SO4+5H2O=Na2SO4+4H3BO3↓ ;正确答案:Na2B4O2+H2SO4+5H2O=Na2SO4+4H3BO3↓。
(3)根据题意可知, NaClO具有氧化性,能够把锰离子氧化为二氧化锰,亚铁离子氧化为铁离子,只有二氧化锰不溶于水的黑色固体,则该反应的离子方程式为ClO-+Mn2++H2O=MnO2↓+Cl-+2H+;正确答案:ClO-+Mn2++H2O=MnO2↓+Cl-+2H+。
(4)加入NaClO溶液后,亚铁离子氧化为铁离子,根据金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2可知,加MgO煮沸,并调整溶液pH=5~6的目的是使Fe3+、Al3+变为沉淀而除去;正确答案:使Fe、Al转化为氢氧化物沉淀除去。
(5) 由表中数据可知,硫酸钙的溶解度随温度的变化不大,硫酸镁的溶解度随温度变化较大,因此可以采用蒸发结晶、趁热过滤的操作除去MgSO4和CaSO4混合溶液中的CaSO4;正确答案:蒸发结晶;趁热过滤。
(6)相比普通过滤,抽滤的优点是过滤速度快,得到的沉淀较干燥;正确答案:过滤速度快,得到的沉淀较干燥。
(7) 硼镁泥主要成分是MgO(占40%),提供的硼镁泥共100g,所以氧化镁的质量为40 g,物质的量为1mol,理论上产生MgSO4·7H2O的量为1mol,质量为246 g,则MgSO4·7H2O的产率为172.2/246 ×100%= 70%;正确答案:70%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分,根据①~⑨在周期表中的位置,用元素符号或化学式回答下列问题:
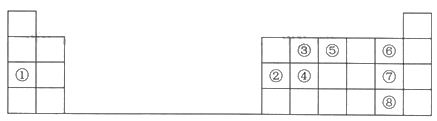
(1)元素④在元素周期表中的位置为________。
(2)最高价氧化物的水化物中碱性最强的物质的电子式为________。
(3)写出②和⑦两种元素的最高价氧化物的水化物相互反应的化学方程式:_______。
(4)④、⑤、⑥三种元素按原子半径由大到小的顺序排列为_______。
(5)③和⑦两种元素形成的简单化合物的结构式为_______,空间构型为________。
(6)设计实验探究⑦、⑧两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、苯。
请完成实验报告单。
步骤一 | 步骤二 | |
实验内容 | 试管1:取少量氯水; 试管2:取少量氯水,滴加少量NaBr溶液。 | 分别向试管1、试管2中加少量______(填试剂),振荡,静置。 |
实验现象 | 试管2中的现象是______。 | 试管2中的现象是_______。 |
实验分析 | 试管1的作用是_____。 | 试管2中反应的离子方程式为_____,此实验的结论是_____。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述错误的是( )
A.1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C.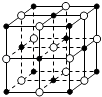 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言,化学用语具有简便、确切地表达化学知识和化学思维的特点.下列化学用语中书写正确的是
A. 氯离子的结构示意图:![]()
B. 次氯酸的结构式:H-O-Cl
C. CO2分子的比例模型:![]()
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
肉桂酸苄酯又名苯丙烯酸苄酯,常作为定香剂,也可用于香皂及食品香精的调香原料。以下是一种合成肉桂酸苄酯的路线。
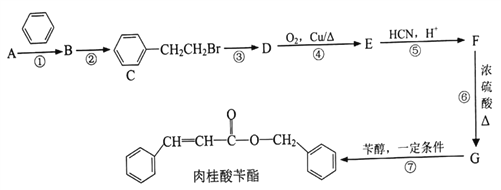
已知:I.相同条件下,烃A对氢气的相对密度为13
Ⅱ.反应①、反应②的原子利用率均为100%
III.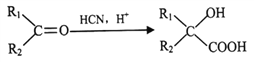
![]()
回答下列问题:
(1)A的名称为____________________。
(2)反应③的条件为____________________。
(3)上述合成路线涉及的反应中,属于取代反应的有___________________〔填编号)。
(4)写出反应D→E的化学方程式__________________________________。
(5)写出G在一定条件下生成的高分子化合物的结构简式__________________。
(6)F同时满足下列条件的同分异构体共有__________种(不考虑立体异构)。
①苯环上有2个取代基
②能发生银镜反应和水解反应
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示6组峰,且峰面积比为3:2:2:1:1:1的是___________(填结构简式)
(7)参照上述合成路线,以CH3CHO为原料,设计制备![]() 的合成线路(无机试剂及溶剂任选) __________________。
的合成线路(无机试剂及溶剂任选) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Mg2+、H+、C1-、OH-B.K+、Ca2+、NO3-、CO32-
C.Mg2+、Na+、SO42-、Cl-D.Na+、H+、CO32-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com